| Aves | |
|---|---|
| Rango temporal: 150,8 Ma-Reciente Tithoniense (Jurásico Superior) - Reciente | |
 La diversidad de las aves modernas |
|
| Clasificación científica | |
| Reino: | Animalia |
| Filo: | Chordata |
| Subfilo: | Vertebrata |
| Infrafilo: | Gnathostomata |
| Superclase: | Tetrapoda |
| Clase: | Avesnota 1 1 Linnaeus, 17582 |
| Subclases | |
Su grupo taxonómico se denomina clase Aves (la palabra es latina y está en plural, en singular sería Avis) para la sistemática clásica, pero en la sistemática filogenética actual este clado no tiene rango, y es incluido a su vez sucesivamente dentro de los clados: Theropoda, Dinosauria, Archosauria, Sauropsida, Tetrapoda, etc., aunque hay más anidamientos intermedios con denominación.
Las aves se originaron a partir de dinosaurios carnívoros bípedos del Jurásico, hace 150-200 millones de años. Su posterior evolución dio lugar, tras una fuerte radiación, a las más de 10 000 especies actuales (la última lista de Clements incluye 10 157 especies vivas más 153 extintas en tiempos históricos).3 Las aves son los tetrápodos más diversos; sin embargo, tienen una gran homogeneidad morfológica en comparación con los mamíferos. Las relaciones de parentesco de las familias de aves no siempre pueden definirse por morfología, pero con el análisis de ADN comenzaron a esclarecerse.
Las aves habitan en todos los biomas terrestres, y también en todos los océanos. El tamaño puede ser desde 6,4 cm en el colibrí zunzuncito hasta 2,74 metros en el avestruz. Los comportamientos son diversos y notables, como en la anidación, la alimentación de las crías, las migraciones, el apareamiento y la tendencia a la asociación en grupos. La comunicación entre las aves es variable y puede implicar señales visuales, llamadas y cantos. Algunas emiten gran diversidad de sonidos, y se destacan por su inteligencia y por la capacidad de transmisión cultural de conocimientos a nuevas generaciones.
El ser humano ha tenido una intensa relación con las aves. En la economía humana las aves de corral y las cinegéticas son fuentes de alimento. Las canoras y los loros son populares como mascotas. Se usa el plumón de patos y gansos domésticos para rellenar almohadas, y antes se cazaban muchas aves para adornar sombreros con sus plumas. El guano de las aves se usa en la fertilización de suelos. Algunas aves son reverenciadas o repudiadas por motivos religiosos, supersticiones o por prejuicios erróneos. Muchas son símbolos culturales y referencia frecuente para el arte. En los últimos 500 años se han extinguido más de 150 especies como consecuencia de actividades humanas,4 y, actualmente, son más de 1 200 las especies de aves amenazadas que necesitan esfuerzos para su conservación.5
Índice
Origen y evolución
Véase también: Aves fósiles
Origen dinosauriano de las aves
Las evidencias fósiles y los numerosos análisis biológicos han demostrado que las aves son dinosaurios terópodos.6 Más específicamente, son miembros de Maniraptora, un grupo de terópodos que incluyen también, entre otros, a dromeosaurios y oviraptóridos.7 A medida que los científicos han descubierto más terópodos no-avianos que están cercanamente relacionados con las aves, la distinción antes clara entre no-aves y aves se ha vuelto borrosa. Los recientes descubrimientos en la provincia de Liaoning del noreste de China demuestran que muchos pequeños dinosaurios terópodos tenían plumas, lo que contribuye a esta ambigüedad de límites.8La visión del consenso en la paleontología contemporánea es que las aves son el grupo más cercano a los deinonicosaurios, que incluyen a dromeosáuridos y troodóntidos. Juntas, estas tres forman el grupo Paraves. El dromaeosaurio basal Microraptor tiene características que pueden haberle permitido planear o volar. Los deinonicosaurios más basales eran muy pequeños. Esta evidencia eleva la posibilidad de que el ancestro de todos los paravianos pudiera haber sido arbóreo, o pudiera haber sido capaz de planear.9 10 Archaeopteryx, del Jurásico Superior, es muy conocido como uno de los primeros fósiles transicionales que fueron encontrados y aportó apoyo a la teoría de la evolución a finales del siglo XIX. Archaeopteryx tiene caracteres claramente reptilianos: dientes, dedos de la mano con garras, y una larga cola similar a la de lagartos, pero tiene alas finamente preservadas con plumas de vuelo idénticas a las de las aves modernas. No se considera un ancestro directo de las aves modernas, pero sí el más antiguo y primitivo miembro de Aves o Avialae, y está probablemente muy cercano al ancestro real. Sin embargo, contradiciendo lo anterior, se ha sugerido por otros autores que Archaeopteryx fue un dinosaurio que no era más cercano a Aves de lo que fueran otros grupos de dinosaurios,11 y que Avimimus es un ancestro más plausible de todas las aves que Archaeopteryx.12
Teorías alternativas y controversias
Han existido muchas controversias con respecto al origen de las aves. Una de las primeras se encontraba relacionada con el posible origen de las aves a partir de arcosaurios y no de dinosaurios (estos descienden de los primeros). Dentro de los que se decidían por los dinosaurios existían también divergencias de criterio en cuanto a si los ancestros más probables eran ornitisquios o saurisquios terópodos.13 Aunque los dinosaurios ornitisquios (gr. "con cadera de ave") compartían con las aves modernas la estructura de la cadera, se piensa que las aves se originaron de dinosaurios saurisquios (gr. "con cadera de lagarto"), y por lo tanto sus caderas evolucionaron independientemente.14 De hecho, una estructura de cadera aviana evolucionó en una tercera ocasión entre un grupo de terópodos peculiares conocidos como Therizinosauridae. Unos pocos científicos todavía sugieren que las aves no son dinosaurios, sino que evolucionaron de arcosaurios primitivos como Longisquama.15 16Diversificación cretácica de aves primitivas
Las aves se diversificaron en una amplia variedad de formas durante el periodo Cretácico.17 Muchos grupos retuvieron sus características primitivas, como alas con garras, y dientes, aunque los dientes se perdieron de forma independiente en algunos grupos de aves, incluidas las aves modernas. Mientras las formas más primitivas, como Archaeopteryx y Jeholornis, retuvieron la cola larga ósea de sus ancestros,17 las colas de las aves más avanzadas se acortaron con la aparición del hueso pigóstilo en el clado Pygostylia.El primer linaje grande y diverso de aves de cola corta que evolucionó fue Enantiornithes (significa "aves opuestas"), llamado así porque la construcción de sus huesos del hombro estaba invertida respecto a la de las aves modernas. Enantiornithes ocupó un amplio espectro de nichos ecológicos, desde sondeadoras en la arena, como las limícolas, y comedoras de pescado, hasta las formas arborícolas y comedoras de semillas.17 Linajes más avanzados se especializaron también en comer pescado, como la subclase Ichthyornithes ("aves-pez") con apariencia de gaviota.18
Un orden de aves marinas del Mesozoico, Hesperornithiformes, se adaptó tan bien a la pesca en ambientes marinos que perdieron la capacidad de volar y se hicieron primariamente acuáticos. A pesar de su especialización extrema, Hesperornithiformes incluye los parientes más cercanos de las aves modernas.17
| Aves |
|
||||||||||||||||||||||||
Radiación evolutiva de las aves modernas
Algunos de los linajes basales de Neornithes comenzaron a evolucionar hacia el final del Cretácico, como demuestra el descubrimiento de Vegavis,19 y se dividieron en dos linajes, los superódenes Palaeognathae y Neognathae. En Palaeognathae se incluyen Tinamiformes y Struthioniformes. Se acepta que la rama Neognathae se dividió antes de finalizar el Cretácico, cuando evolucionó el clado basal Galloanserae (que contiene patos, gallos y formas afines). No existe acuerdo sobre cuándo ocurrió la división múltiple de las demás neognatas, o clado Neoaves, si antes o después del evento de extinción del límite Cretácico-Terciario cuando desaparecieron los demás dinosaurios.20 Este desacuerdo se debe en parte a la divergencia de las evidencias. La datación molecular sugiere una radiación cretácica, mientras que las evidencias fósiles solo prueban la radiación en el Terciario. Los intentos de reconciliar las evidencias moleculares y fósiles han sido controvertidos.20 21 Fósiles de pingüinos primitivos de 61 millones de años de antigüedad han servido para hacer una calibración de la datación molecular que implica que el grupo corona Neoaves ya se había diversificado antes del evento de extinción Cretácico-Terciario. Además se puede estimar a partir de esto que por lo menos hace 72 millones de años ya había ocurrido la separación del linaje de las aves acuáticas superiores del de las limícolas. Luego esos linajes ya diversificados de las Neornithes actuales tuvieron durante el Paleoceno una radiación adaptativa explosiva cuando se desarrollaron 16 nuevos órdenes. En el final del Mioceno ya existían la mayoría de los géneros de aves actuales. El número de especies de aves puede haber llegado hasta 21 000 hacia el principio del Pleistoceno (hace 1,5 millones de años), pero se redujo a cerca de la mitad debido a los cambios climáticos, las glaciaciones, y los intercambios faunísticos entre continentes.22 El número de especies de aves vivientes se establece entre unas 98003 y 10 050.23 Se estima que cuando se termine la caracterización por secuenciación de ADN de todas las aves puedan identificarse numerosas nuevas especies mediante identificación de formas crípticas dentro de especies reconocidas basándose en las diferencias de ADN.22
Al igual que el i-iwi, las demás especies de la subfamilia Drepanidinae se han diversificado y adaptado a los diferentes nichos ecológicos del archipiélago de Hawái.
Taxonomía
La primera clasificación científica de las aves se debe a Francis Willughby y John Ray en su libro Ornithologiae, publicado en 1676.27 Carlos Linneo modificó aquel trabajo en 1758 para crear la clasificación taxonómica aún en uso.28 Las aves están categorizadas como una clase homónima en la Taxonomía de Linneo. En la taxonomía filogenética, las aves se ubican en el clado Theropoda (dinosaurios carnívoros bípedos).29Clasificación cladística
El establecimiento del origen dinosauriano del clado Aves ha tenido como consecuencia su clasificación filogenética con anidación sucesiva dentro de los siguientes clados:-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
- Clado (sin clasif.)Paraves,
- Clado (sin clasif.)Maniraptora,
-
- Clado (sin clasif.)Maniraptoriformes,
-
- Clado (sin clasif.)Tyrannoraptora,
-
- infraorden:Coelurosauria,
-
- Clado (sin clasif.) :Tetanurae,
-
- Suborden: Theropoda,
-
- Orden: Saurischia,
-
- Superorden: Dinosauria,
-
- Clado (sin clasif.)Archosauria,
-
- Infraclase Archosauromorpha,
-
- Subclase Diapsida,
-
- clase Sauropsida (igual a Reptilia en sentido ampliado),
-
- Clado (sin clasif.)Amniota,
-
- CladoReptiliomorpha,
-
- SuperclaseTetrapoda,
-
- Infrafilo: Gnathostomata
-
- SubfiloVertebrata,
-
- Filo Chordata,
-
- SuperfiloDeuterostomia,
-
- Linaje:Coelomata
-
- Rama:Bilateria = Triblásticos ,
-
- SubreinoEumetazoa
-
- Reino: Animalia
Las aves, junto a su orden hermano (Crocodilia), representan los únicos sobrevivientes del clado reptiliano Archosauria. Filogenéticamente, el clado Aves se define comúnmente como todos los descendientes del ancestro común más reciente de las aves modernas y de Archaeopteryx lithographica.30 Archaeopteryx, perteneciente al Jurásico Superior (entre 156-150 millones de años), es el animal más antiguo hasta ahora conocido que se clasifica como un ave. Otros autores han definido Aves para agrupar solamente a las más modernas, excluyendo a la mayoría de los grupos de aves solamente conocidos por sus fósiles,31 en parte para evitar las incertidumbres sobre la ubicación de Archaeopteryx en relación con los animales tradicionalmente conocidos como dinosaurios terópodos.32 33
Clasificación de las aves modernas
La clasificación de las aves es un asunto disputado. Como resumen Livezey y Zusi,29 en 20 años desde 1988, han sido numerosas y divergentes las filogenias de Aves propuestas. Han estado basadas en metodologías diversas y aplicadas con amplitudes dispares, que generalmente han usado alternativamente morfología, secuencias de ADN mitocondrial o de ADN nuclear; con y sin análisis cladísticos. Sin embargo, se han producido resultados discordantes incluso cuando los estudios se han basado en metodologías de un mismo tipo.29 Estos estudios dejan un panorama contradictorio donde los resultados están en constante fluidez y no hay ninguna versión de filogenia ampliamente aceptada, por lo que no es posible dar aquí una filogenia más o menos definitiva. La situación parece en vías de solución con los nuevos descubrimientos de fósiles que están permitiendo estudios más refinados basados en morfología,29 con el perfeccionamiento de los métodos estadísticos, con la expansión de las evidencias moleculares por el aumento de los loci analizados y con la aplicación de estos métodos a más amplias representaciones de grupos taxonómicos.29 34 Con estas progresivas mejoras se considera cuestión de poco tiempo que se alcancen resultados que logren un consenso de la comunidad científica sobre la evolución de los órdenes y familias de aves modernas. Estos resultados quizás puedan ser acelerados con estudios basados en "evidencia total", con el análisis combinado de todas las fuentes de evidencia.29La clasificación filogenética de los grupos de aves modernas que a continuación se presenta, se basa en un estudio de las secuencias de ADN de Hackett y colaboradores (2008),34 realizado mediante el examen de cerca de 32 kilobases de secuencias alineadas provenientes de 19 loci independientes de ADN nuclear en 169 especies de aves, que representan a todos los grupos mayores existentes. En ella se confirma la monofilia de Galloanserae y Neoaves. Se refuerza, a su vez, la existencia de diversos clados propuestos a lo largo de los últimos años dentro de Neoaves, aunque las relaciones entre la gran mayoría aún están indeterminadas, lo cual genera una serie de politomías. Hackett y colaboradores consolidan en gran medida los estudios de Fain & Houde (2004) y Ericson et ál. (2006), y se destaca en todos ellos la división de Neoaves en dos ramas: Metaves y Coronaves.35 36 Aunque esta división se basa en un único gen (beta-fibrinógeno) y, además, se contrapone con los resultados obtenidos a partir de estudios del ADN mitocondrial.37 La validez de Metaves y Coronaves dependerá de futuros estudios. A continuación se definen nuevos clados (identificados solo con letras) y se señala el carácter parafilético de algunos grupos (que deben ser redefinidos). Véase la lista de familias de aves para más detalles dentro de los órdenes.
| Neornithes |
|
||||||||||||||||||||||||
basada en la Taxonomía de Sibley-Ahlquist.
- Palaeognathae (Clado R)
- Struthioniformes (avestruz, kiwis, emúes, casuarios y ñandúes; parafilético con Tinamiformes)
- Tinamiformes (tinamúes; derivado dentro de Struthioniformes)
- Neognathae (Clado Q)
- Galloanserae (Clado P)
- Anseriformes, como el cisne
- Galliformes, como la gallina
- Neoaves
- Clado O
- Phaethontiformes (rabijuncos)
- Pterocliformes (gangas)
- Mesitornithidae (mesitos)
- Columbiformes (palomas)
- Clado N
- Clado M (Cypselomorphae)
- Caprimulgiformes, como el chotacabras (parafilético con el clado L)
- Clado L (derivado dentro de Caprimulgiformes)
- Apodiformes, como el vencejo y el colibrí
- Aegotheliformes, como el egotelo
- Opisthocomiformes (hoatzin)
- Clado K
- Clado J
- Otididae (avutardas)
- Cuculiformes (cucos)
- Gruiformes, como la grulla
- Clado I
- Musophagidae (turacos)
- Clado H (“Aves acuáticas superiores”)
- Gaviiformes (colimbos)
- Sphenisciformes (pingüinos)
- Procellariiformes (albatros y petreles)
- Ciconiiformes, como la cigüeña (parafilético con Pelecaniformes)
- Pelecaniformes, como el pelícano (parafilético con Ciconiiformes)
- Clado J
- Clado G
- Charadriiformes, como la gaviota (que incluye además al Llanero y a los torillos)
- Clado F (“Aves terrestres superiores”)
- Clado E
- Accipitriformes como el águila
- Cathartiformes, como el cóndor andino
- Strigiformes, como la lechuza
- Coliiformes, como el pájaro ratón
- Clado D
- Leptosomatidae (carraca curol)
- Trogoniformes, como el quetzal
- Clado C
- Coraciiformes, como el martín pescador (parafilético con Piciformes)
- Piciformes, como el tucán y el carpintero (derivado dentro de Coraciiformes)
- Cariamidae como la chuña
- Clado B
- Falconidae, como el halcón
- Clado A
- Psittaciformes, como el guacamayo
- Passeriformes, como el gorrión
- Clado E
- Galloanserae (Clado P)
Distribución

El área de distribución del gorrión común ha aumentado drásticamente debido a las acciones antrópicas.39
- Véase también: Avifaunas por país y por región
Tradicionalmente se ha considerado que la alta diversidad tropical era resultado de unas mayores tasas de especiación; sin embargo, estudios recientes descubrieron que en las altas latitudes hay mayores tasas de especiación que son compensadas por tasas de extinción más altas.47 Numerosas familias de aves se han adaptado a vivir en el mar, algunas especies de aves marinas solo recalan en tierra para criar,48 y se sabe que algunos pingüinos llegan a bucear hasta a 300 m de profundidad.49
Muchas especies de aves se han establecido en regiones donde han sido introducidas por el hombre. Algunas de estas introducciones han sido deliberadas; el faisán común, por ejemplo, ha sido introducido como especie para la caza por buena parte del mundo.50 Otras introducciones han sido accidentales, este es el caso de varias especies de loros, como la cotorra argentina que a partir de ejemplares cautivos escapados se ha establecido en numerosas ciudades de Norteamérica,51 Sudamérica y Europa.52 Algunas especies, como la garcilla bueyera,53 el chimachimá,54 o la cacatúa galah,55 se han introducido de forma natural en regiones fuera de sus áreas de distribución original, gracias a que la agricultura ha creado ecosistemas adecuados para estas especies.
Anatomía y fisiología
La anatomía de las aves presenta un plan corporal que exhibe un gran número de adaptaciones inusuales en comparación con otros vertebrados, en su mayor parte para facilitar el vuelo.El esqueleto está formado de huesos huecos, pero de estructura resistente, lo que les confiere ligereza a las aves. Estas cavidades óseas están llenas de aire y conectan con el aparato respiratorio.56 Los huesos del cráneo están fusionados, sin presentar suturas craneales.57 Las órbitas son grandes y separadas por un septo óseo. La columna vertebral de las aves presenta un gran contraste entre las zonas superiores y las inferiores. El número de vértebras cervicales es muy variable, aunque siempre numeroso y el cuello es especialmente flexible, pero en las vértebras torácicas anteriores la movilidad es reducida, y en todas las posteriores la movilidad es nula, dado que están fusionadas.58 Las pocas vértebras posteriores están fusionadas con la pelvis para formar el sinsacro.57 Las costillas son aplastadas y el esternón es aquillado para el anclaje de los músculos del vuelo, excepto en los órdenes de aves terrestres no voladoras. Las extremidades anteriores están modificadas en forma de alas.59
Los pies de las aves están clasificados según la disposición de sus dedos en anisodáctilos, zigodáctilos, heterodáctilos, sindáctilos y pamprodáctilos.60 La mayor parte de las aves tienen cuatro dedos (aunque hay muchas especies tridáctilas y algunas didáctilas) que se organizan en torno a un ancho y fuerte metatarso.61
Como los reptiles, las aves son primariamente uricotélicos, es decir, sus riñones extraen desechos nitrogenados de su sangre y los excretan como ácido úrico, en vez de urea o amoníaco, a través de los uréteres hacia el intestino. Las aves no tienen vejiga urinaria o apertura urétrica externa y el ácido úrico se excreta junto con las heces como desperdicio semisólido.62 63 Sin embargo, aves como los colibríes pueden ser facultativamente amoniotélicos, al excretar la mayor parte de los desechos nitrogenados en forma de amoníaco.64 Las razones de esto son diversas y no están del todo claras, aunque sus dietas basadas en el néctar, por lo tanto con grandes aportes de agua, juegan un papel clave. También se debe a que sus metabolismos requieren poco nitrógeno, y a bajas ingestiones de proteínas y sal. Cuando estas condiciones cambian, se reduce la ingesta de néctar o suben las proteínas y sales obtenidas, estas aves pueden pasar a ser uricotélicas.65 66 Pueden excretar también creatina, en vez de creatinina como los mamíferos.57 Esta materia, así como la fecal de los intestinos, es expulsada a través de la cloaca del ave.67 68 La cloaca es una abertura multipropósito: por ella se expulsan los desechos, las aves se aparean juntando sus cloacas y las hembras ponen huevos a través de ella. Adicionalmente, muchas especies regurgitan egagrópilas.69
El aparato digestivo de las aves es único, con un buche para almacenamiento de lo ingerido y una molleja que contiene piedras que el ave ha tragado y que sirven para triturar el alimento para compensar la ausencia de dientes.70 La mayoría de las aves están adaptadas a una rápida digestión para ayudar al vuelo.71 Algunas aves migratorias se han adaptado a usar proteínas de muchas partes del cuerpo, incluidas proteínas de los intestinos, como fuente adicional de energía durante la migración.72
Las aves son animales homeotérmicos, es decir, que la temperatura interna se mantiene regulada, por encima de la temperatura exterior, lo que les permite tener un elevado metabolismo; el plumaje participa en su regulación. La temperatura media interna de las aves adultas es bastante alta, en general entre 40 y 43 °C, con variaciones entre especies. Algunas Apodiformes tienen temperaturas nocturnas notablemente menores. Ciertas aves, como los reyezuelos, cuando son recién nacidos mantienen la temperatura ambiental (poiquilotermia), y adquieren la capacidad de regularla pocos días después.73
Las aves tienen uno de los aparatos respiratorios más complejos del reino animal.57 Tras la inhalación, el 75% del aire fresco pasa de largo de los pulmones y fluye directo a los sacos aéreos posteriores, que se extienden desde los pulmones y conectan con los espacios en los huesos, y los llenan con aire. El otro 25% del aire va directamente a los pulmones. Cuando el ave exhala, el aire usado fluye fuera de los pulmones y el aire almacenado de los sacos aéreos posteriores es simultáneamente forzado a entrar en los pulmones. De este modo, los pulmones de un ave reciben un suministro constante de aire fresco tanto en la inhalación como en la exhalación.74 La producción de sonidos se logra usando la siringe, una cámara muscular con varias membranas timpánicas que está situada en el extremo inferior de la tráquea, desde la cual se separa.75
El corazón de las aves tiene cuatro cámaras separadas (dos aurículas y dos ventrículos) y es el arco aórtico derecho el que da lugar a la circulación sistémica (al contrario que en los mamíferos, en los que el involucrado es el arco aórtico izquierdo).57 La vena cava inferior (única) recibe sangre de las patas por vía del sistema porta renal (muy reducido). La mayor parte de esta sangre proveniente de la cintura pélvica y la cola, pasa al corazón sin pasar por los capilares renales. Los glóbulos rojos tienen núcleo, a diferencia de los mamíferos, y son ovales y biconvexos.76
El sistema nervioso es grande en relación al tamaño del ave.57 La parte más desarrollada del encéfalo es la que controla las funciones relacionadas con el vuelo, mientras el cerebelo coordina el movimiento, y los hemisferios cerebrales controlan patrones de comportamiento, la orientación, el apareamiento y la construcción del nido.
Unas pocas especies son capaces de usar defensas químicas contra sus depredadores. Algunos Procellariiformes pueden expulsar aceites repulsivos contra sus atacantes,77 y algunas especies en el género Pitohui de Nueva Guinea tienen una potente neurotoxina en su piel y plumas.78
Sentidos
Los sentidos de las aves no deberían diferir básicamente de los mamíferos, pero para algunos de ellos quedan incógnitas: no se sabe muy bien, por ejemplo, cómo logran orientarse en sus migraciones.
Ojo de un búho real, una rapaz nocturna con una gran vista.
La mayoría de las aves tienen un pobre sentido del olfato, pero hay excepciones notables como los kiwis,87 las aves carroñeras americanas,80 88 y los albatros y petreles.89 Se ha comprobado que estas últimas son capaces de localizar sus presas, en particular el aceite de pescado, olfateándolo.90 91
El oído de las aves está bien desarrollado; aunque carece de pabellón auricular, está cubierto por plumas, y en algunas, como en los géneros de búhos Asio, Bubo y Otus, forman penachos que parecen orejas. Ciertas especies de búho pueden localizar una presa en la oscuridad completa solo con la audición.79 Sin embargo, la ausencia de orejas les obliga a realizar rotaciones de la cabeza para percibir los sonidos provenientes de diferentes direcciones. Las salanganas y el guácharo de las cavernas son capaces de desplazarse en la oscuridad, gracias a que sus oídos están adaptados a la ecolocalización. Al contrario que los mamíferos, el oído medio de las aves tiene un solo huesecillo, la columela. En el oído interno, la cóclea no es espiralada, sino recta, al contrario que en los mamíferos.80 92
Las papilas gustativas no se encuentran en el extremo de la lengua, sino en el fondo y en la garganta; además son poco numerosas (200 en una Anatinae, frente a las 9 000 en el hombre), pero otros mecanismos pueden ser accionados para la degustación, como el sentido del tacto (notable a nivel del pico) que, en muchas aves, parece intervenir durante la búsqueda de alimento. En el sentido del tacto intervienen diversos corpúsculos: los corpúsculos encapsulados de Merkel (en la piel y en el interior de la boca) y los de Grandry (en el paladar) participan en la sensibilidad táctil general; estos serían los correspondientes al corpúsculos de Meissner en los mamíferos.93
Los corpúsculos de Herbst (que corresponden a los corpúsculos de Pacini de los mamíferos93 ) son preferentemente sensibles a las vibraciones; son particularmente numerosos en el pico y las patas, particularmente en las especies que deben encontrar su alimento “a tientas”: lengua en Picidae, pico en Anatidae y en numerosos Scolopacidae, pero también en los rebordes coloreados que bordean los picos de las crías de numerosos paseriformes y Picinae.80
Las aves poseen varios órganos de equilibrio independientes; el oído interno, como en los mamíferos, y un órgano situado en la pelvis.
Uno de los sentidos más misteriosos es la detección del campo magnético terrestre, el órgano que lo detecta se sitúa en el pico o cerca de los ojos.79 La existencia de este sentido fue demostrada experimentalmente por primera vez en 1967 por Wolfgang Wiltschko en los petirrojos europeos.94
Cromosomas sexuales
El sexo en las aves se determina por cromosomas sexuales, denominados Z y W. Las hembras son heterogaméticas y los machos homogaméticos. Esto significa que la hembra tiene sus cromosomas sexuales diferentes (ZW) y produce dos tipos de óvulos, lo que determina el sexo del futuro cigoto. En el macho, en cambio, sus cromosomas sexuales son idénticos (ZZ) y sus espermatozoides, todos portadores de cromosoma Z, no determinan el sexo de la descendencia. Lo contrario ocurre en los mamíferos, donde los cromosomas sexuales, llamados en este caso X e Y, son diferentes en el macho (XY), y en la hembra son similares (XX).57En todas las especies de aves, el sexo del individuo se determina en la fertilización. Sin embargo, un estudio reciente ha demostrado que en el caso de los talégalos cabecirrojos la temperatura durante la incubación influye en la relación de sexos en la descendencia; a mayores temperaturas, más proporción de hembras y viceversa;95 pero esto no se debe a que la temperatura altere los mecanismos genéticos de determinación del sexo, sino a que con temperaturas extremas de incubación, el desarrollo y mortalidad de los pollos es diferente según su sexo: a altas temperaturas los machos se desarrollan peor y mueren más, y a bajas temperaturas le ocurre lo mismo a las hembras.96
Piel, plumaje y escamas
A diferencia de la piel de los mamíferos, la de las aves es delgada y seca; no posee glándulas sudoríparas; de hecho, la única glándula cutánea de las aves es la glándula uropígea, situada en la base de la cola, que secreta grasa que el ave esparce por su plumaje con el pico; dicha glándula está especialmente desarrollada en las aves acuáticas, con lo que consiguen una mayor impermeabilización.97Las plumas son una característica única de las aves. Les permiten volar, proporcionan aislamiento térmico al impedir la circulación del aire que ayuda en la termorregulación, y son usadas para la exhibición, camuflaje, e identificación.57 Hay varios tipos de plumas, y cada una tiene unas funciones y características determinadas: las plumas de vuelo o rémiges (primarias, secundarias y terciarias); las rectrices (plumas de la cola, que sirven como timón en el vuelo); las coberteras (que cubren parcialmente las rémiges y también las rectrices); las tectrices (que cubren todo el cuerpo y lo protegen frente a agentes adversos) y el plumón (que evita la perdida de calor).61 Las plumas son formaciones epidérmicas de queratina unidas a la piel y surgen solo en series específicas de la piel llamadas pterilos. El patrón de distribución de estas series de plumas (pterilosis) se usa en taxonomía y sistemática. El ordenamiento y el aspecto de las plumas en el cuerpo, llamado plumaje, puede variar dentro de la especie por edad, posición social,98 y sexo.99

El plumaje del autillo africano le permite camuflarse entre los troncos de los árboles.
Antes de anidar, en las hembras de la mayoría de las especies de aves se produce lo que se llama una placa de incubación, es decir, una zona libre de plumas cerca del abdomen. La piel está allí bien irrigada con vasos sanguíneos y ayuda al ave en la incubación.106

Lori rojo acicalándose.
Las escamas de las aves se componen de la misma queratina que las plumas, el pico, las garras y espolones. Se encuentran principalmente en los dedos del pie y en el metatarso, pero pueden encontrarse más arriba hasta el talón en algunas aves. La mayoría de las escamas de las aves no se superponen significativamente, excepto en los casos de los martín-pescadores y los carpinteros. Se piensa que las escamas de las aves son homólogas a las de los reptiles y mamíferos.110
Vuelo

Un águila pescadora en un momento de su vuelo.
Alrededor de 60 especies de aves son no voladoras, también un buen número de especies extintas carecían de la capacidad de volar.111 Las aves no voladoras a menudo se encuentran en islas aisladas, probablemente debido a una escasez de recursos y a la ausencia de depredadores terrestres.112 A pesar de que no pueden volar, los pingüinos usan una musculatura y unos movimientos similares para "volar" a través del agua; así lo hacen también los álcidos, las pardelas y los mirlos acuáticos.113
Dimensiones

La avutarda es una de las aves voladoras más pesadas del mundo.
Los albatros viajeros poseen la mayor envergadura alar de todos los animales voladores actuales, pueden exceder los 340 cm, con peso de más de 10 kg.121 122 La gigantesca ave fósil Argentavis magnificens es la mayor ave voladora que se ha descubierto; se estima que su envergadura era de más de 5,8 metros y un peso de 60–80 kg.122 Son varias las especies actuales de aves voladoras consideradas como las más pesadas, las cuales no suelen superar los 20 kg, entre ellas la avutarda común y la avutarda kori.123 El cóndor andino no supera a las anteriores pero es un ave voladora de dimensiones considerables, con una longitud de hasta 120 cm, envergadura que llega a los 320 cm y un peso de hasta 15 kg.122 124
Ritmos biológicos

La muda (en este caso en un pingüino emperador) es un proceso asociado a los ritmos biológicos de cada ave.
Las aves, debido a la existencia de estaciones, siguen también un ritmo circanual. Las aves que migran grandes distancias sufren generalmente cambios anatómicos o de comportamiento (como por ejemplo el zugunruhe) o una muda para preparase para el viaje. Según la estación, ciertas especies pueden realizar igualmente migraciones diarias, altitudinales por ejemplo, o para llegar a sus zonas de aprovisionamiento.
Los ritmos circadianos y estacionales parecen estar ligados a la duración del día. Los ciclos de reproducción son anuales, pero en ciertas especies particularmente prolíficas pueden sacar adelante varias nidadas una misma estación.
Longevidad
La duración de la vida de las aves es muy variable según las especies, puede ser de tres o cuatro años para algunas paseriformes, a más de 50 años para los albatros, petreles y pardelas, o incluso más de 60 años para ciertas especies raras como el kakapo.126 Para deducir aproximadamente la edad de un ave hay que tener buenos conocimientos sobre fenómenos como las variaciones de la muda según la edad (además de la estación),127 o la neumatización del esqueleto al envejecer.Inteligencia

Cotorra del sol demostrando las capacidades de los loros para resolver puzles.
Las aves son capaces de aprender; se sabe por ejemplo que los cucos aprenden los cantos de sus padres adoptivos o que los cuervos hacen su aprendizaje imitando a sus semejantes.129 Sus capacidades más comunes son ciertamente la representación espacial (que les permite orientarse, reencontrar sus fuentes de alimento o construir nidos sofisticados) y la capacidad de comunicación.
Una de las capacidades más sorprendentes es la aptitud bastante difundida de servirse de un objeto como utensilio.130 El cuervo neocaledoniano, por ejemplo, es capaz de usar un palo para sacar de los troncos los insectos con los que se nutre. Ciertas aves son también capaces de contar, como los loros, que son también conocidos no solo por reproducir la voz humana, sino también por comprender lo que dicen y utilizar su vocabulario con acierto.
Se ha observado igualmente a aves capaces de "medicarse", por ejemplo al ingerir arcilla para combatir los efectos nefastos de toxinas alimentarias.131
Ciertas facultades son prácticamente únicas, el abejaruco verde chico es capaz de "meterse en la cabeza" de sus predadores, es decir de calcular lo que el predador puede ver o no.132
Comportamiento
La mayoría de las aves son diurnas, pero algunas especies, sobre todo búhos y chotacabras, son nocturnas o crepusculares; y muchas aves limícolas costeras se alimentan cuando las mareas les son propicias ya sea de día o de noche.133Dieta y alimentación
La dieta de las aves incluye una gran cantidad de tipos de alimentos como néctar, frutas, plantas, semillas, carroña, y diversos animales pequeños, incluidas otras aves.57 Como las aves no tienen dientes, su aparato digestivo está adaptado a procesar alimentos sin masticar que el ave traga enteros.Las aves llamadas generalistas son las que emplean muchas y diferentes estrategias para conseguir alimentos de una amplia variedad de tipos, mientras que las que se concentran en un espectro reducido de alimentos o tienen una única estrategia para conseguir comida son consideradas especialistas.57 Las estrategias de alimentación de las aves varían según la especie. Algunas cazan insectos lanzándose sorpresivamente desde una rama. Las especies que se alimentan de néctar, como los colibríes, los suimangas y los loris, tienen lenguas pelosas y formas de pico especialmente adaptadas para ajustarse a las plantas de las que se alimentan.134 Los kiwis y las aves limícolas tienen largos picos que usan para sondear el suelo en busca de invertebrados; en el caso de las limícolas, sus picos presentan diferentes longitudes y curvaturas, ya que cada especie tiene un nicho ecológico diferente.57 135 Los colimbos, patos buceadores, pingüinos y álcidos persiguen a sus presas bajo el agua, usando sus alas y/o sus pies para propulsarse,48 mientras que los alcatraces, martines pescadores y charranes son predadores aéreos que se sumergen en picado en busca de su presa. Los flamencos, tres especies de petreles, y algunos patos, se alimentan filtrando el agua.136 137 Otras aves, como los gansos y los patos nadadores, se alimentan principalmente pastando. Algunas especies, entre las que se incluyen las fragatas, las gaviotas,138 y los págalos,139 son cleptoparásitas, es decir, roban comida a otras aves. Se supone que con esto logran un suplemento adicional, pero no una parte importante de su dieta general; un caso estudiado de cleptoparasitismo de la fragata grande sobre el alcatraz enmascarado determinó que obtenían en promedio solo el 5% de su comida, y como máximo un 40%.140 Hay otras aves que son carroñeras, algunas de las cuales, como los buitres, están especializados en comer cadáveres, mientras que otras, como las gaviotas, los córvidos o algunas aves de presa lo hacen solo como oportunistas.141
Ingesta de agua
La mayoría de las aves necesitan beber, aunque su demanda fisiológica de agua se ve reducida por la excreción uricotélica y la ausencia de glándulas sudoríparas.142 Además, pueden refrescarse moviéndose a la sombra, metiéndose en el agua, jadeando, agitando su garganta, o con algunos comportamientos especiales como la urohidrosis. Algunas aves del desierto pueden obtener toda el agua que necesitan de su alimento. También pueden presentar otras adaptaciones, como permitir que la temperatura de su cuerpo se eleve, lo que evita la pérdida de humedad que se produciría mediante el enfriamiento por evaporación o por jadeo.143 Las aves marinas pueden beber agua del mar, ya que tienen unas glándulas en la cabeza que usan para eliminar el exceso de sal, que expulsan a través de las fosas nasales.144La mayor parte de las aves recogen el agua con el pico y después elevan su cabeza para dejar que el agua caiga por la garganta. Todas las palomas y algunas especies, especialmente en las zonas áridas, pertenecientes a las familias de los pinzones tejedores, los cólidos, los turnícidos y las avutardas, son capaces de beber agua sin necesidad de echar para atrás la cabeza.145 Algunas especies del desierto dependen de fuentes de agua; tal es el caso de las gangas que se concentran diariamente en grandes números en los abrevaderos, y transportan el agua para sus pollos en las plumas mojadas del vientre.146
Migraciones y desplazamientos
Muchas especies de aves migran para aprovecharse de las diferencias estacionales de temperatura en el mundo, con lo que optimizan la disponibilidad de fuentes de alimento y de hábitats reproductivos. Las migraciones varían mucho según la especie. Muchas realizan largas migraciones anuales, por lo general provocadas por los cambios en la duración del día así como por las condiciones meteorológicas. Estas aves se caracterizan por pasar la temporada de cría en regiones templadas o polares, e invernar en regiones templadas más cálidas, tropicales, o en el hemisferio contrario.Antes de la migración incrementan sustancialmente sus grasas y reservas corporales, y reducen el tamaño de algunos de sus órganos.147 148 La migración es una actividad que consume mucha energía, sobre todo cuando el ave debe cruzar desiertos y océanos sin poder reabastecerse. Las aves terrestres tienen una autonomía de vuelo de unos 2500 km y las aves limícolas de unos 4000 km,57 aunque la aguja colipinta puede llegar a volar 10 200 km sin parar.149 Las aves marinas también llevan a cabo largas migraciones; la migración anual más larga es la realizada por la pardela sombría, que cría en Nueva Zelanda y Chile y pasa el verano del Hemisferio Norte alimentándose en el Pacífico Norte (Japón, Alaska y California); en total hace unos 64 000 km al año.150 Otras aves marinas se dispersan después de la época de cría, viajando mucho pero sin una ruta establecida. Los albatros, que crían en el océano Antártico, a menudo realizan viajes circumpolares en los períodos no reproductivos.151

Mapa que representa las rutas migratorias de la aguja colipinta. Esta especie tiene el récord de migración más larga sin paradas, unos 10.200 km
La capacidad de las aves de volver a un lugar concreto tras recorrer grandes distancias se conoce desde hace cierto tiempo; en un experimento realizado en la década de 1950, una pardela pichoneta liberada en Boston, volvió a su colonia en Skomer (Gales) en 13 días, cubriendo una distancia de 5150 km.157 Las aves se orientan durante la migración usando diversos métodos; durante el día usan el sol para guiarse, y las estrellas son la referencia por la noche. Las especies que se orientan por el sol usan un reloj interno para compensar los cambios de posición del astro a lo largo del día.57 La orientación a partir de las estrellas se basa en la posición de las constelaciones alrededor de los polos celestes.158 En algunas especies, esto es reforzado además con su capacidad de sentir el magnetismo de la Tierra a través de fotorreceptores especializados.159
Comunicación
Véase también: Vocalización de las aves

Con el plumaje y la exhibición, la tigana busca imitar a un gran depredador.
En ocasiones usan su plumaje para establecer o reafirmar su posición social;160 para indicar su receptividad sexual, o para intimidar, como en el caso de la exhibición de la tigana que busca ahuyentar a sus predadores y proteger a sus pollos.161 Las variaciones del plumaje permiten la identificación de las aves, sobre todo entre especies. La comunicación visual en las aves incluye exhibiciones rituales, que se conforman de acciones "habituales" como acicalarse las plumas, picotazos y otros. Estas demostraciones pueden ser señales de amenaza o de sumisión, o contribuir a la formación de parejas.57 Las exhibiciones más elaboradas se dan en el cortejo, a menudo compuesto de complejas combinaciones de muchos movimientos distintos;162 el éxito reproductivo de los machos puede depender de la calidad de dichas exhibiciones.163
Canto de un mirlo común.
Sociabilidad

El quelea común, el ave más numerosa del mundo,170 se agrupa en enormes bandadas que en ocasiones alcanzan decenas de miles de ejemplares.
También, en ocasiones, las aves forman asociaciones con especies que no son aves. Algunas aves marinas se asocian con los delfines y atunes, que empujan los bancos de peces hacia la superficie y las aves se zambullen para pescarlos.173 Los cálaos tienen una relación mutualista con la mangosta enana, se alimentan juntos y se alertan de la cercanía de aves de presa y otros depredadores.174
Descanso

Muchas aves, como este flamenco común, recogen su cabeza en su espalda para dormir.

Cópula de dos ostreros euroasiáticos.
Reproducción
Las aves han desarrollado un comportamiento reproductor más complejo que la mayoría de los vertebrados. Durante la época de reproducción realizan una serie de rituales, algunos de ellos muy elaborados, como el cortejo del macho para aparearse con la hembra, o la construcción de nidos para llevar a cabo la puesta de huevos.Las aves se reproducen mediante fecundación interna y ponen huevos provistos de una cubierta calcárea dura (el cascarón).184
Tipos de emparejamiento

Los falaropos picofino tienen un método de emparejamiento no muy común. Es un sistema poliándrico en el que los machos se encargan de la incubación y de cuidar de los pollos, y las hembras compiten por los machos.185
Otros sistemas de emparejamiento, como la poliginia, poliandria, poligamia, poliginandria y la promiscuidad también se dan en aves.57 Los sistemas poligámicos se dan en especies donde las hembras son capaces de criar a sus pollos sin la necesidad de los machos.57 Algunas especies usan más de uno de estos sistemas según las circunstancias.
En la reproducción normalmente se realiza alguna forma de exhibición de cortejo, por lo general realizada por el macho.192 La mayor parte de estas exhibiciones son bastante simples e incluyen algún tipo de canto. Sin embargo otras están muy elaboradas. Dentro de los despliegues nupciales más llamativos se encuentran los realizados por las aves del paraíso de Nueva Guinea193 y los bailarines del Neotrópico.194 Según la especie pueden incluir golpeteos y tamborileos con las alas o la cola, bailes y vuelos acrobáticos en arenas de combate (leks). Las hembras suelen ser las que eligen a su pareja,195 aunque en algunas especies poliándricas, como el falaropo picofino, es al revés, los machos, que son de colores poco llamativos, son los que eligen a las hembras de plumaje colorido y brillante.196 Los acicalamientos mutuos, las cebas de cortejo, y los roces y "besos" con los picos son comportamientos comunes, generalmente después de que se hayan emparejado.71
Territorios, nidos e incubación
Véase también: Nido de las aves

Nido y huevos de mirlo común.

Las colonias de cría del tejedor sociable se encuentran entre las estructuras más grandes creadas por las aves.
Los huevos suelen ser incubados en un nido. La mayor parte de las especies construyen un nido más o menos trabajado, que puede ser una copa, una bóveda, una plataforma, un montículo, una madriguera o una simple escarbadura en el suelo.199 Algunos nidos son, en cambio muy sencillos; los albatros ponen los huevos casi directamente sobre el suelo. La mayor parte de las aves ubican sus nidos en lugares protegidos y ocultos para evitar a los depredadores, pero en las especies coloniales, que tienen mayor capacidad de defensa, los nidos se sitúan en zonas más expuestas. Durante la construcción, algunas especies recogen plantas provistas de toxinas dañinas para los parásitos, lo que favorece la supervivencia de sus pollos,200 y a menudo se usan las plumas como aislamiento térmico.199 Varias especies de aves no tienen nidos; el arao común cría en acantilados donde deposita los huevos directamente sobre la roca, y el pingüino emperador guarda e incuba sus huevos entre sus pies y su cuerpo. La ausencia de nidos es más común en especies que anidan en el suelo, ya que sus pollos suelen ser precoces.
La incubación generalmente comienza cuando se ha puesto el último huevo y tiene el fin de optimizar su temperatura para el correcto desarrollo del embrión.57 En las especies monógamas la incubación suele ser una tarea compartida, mientras que en las especies polígamas el encargado es solo uno de los progenitores. El calor de los padres pasa a los huevos a través de unas zonas concretas del vientre o del abdomen del ave que han perdido las plumas y tienen la piel descubierta. La incubación puede ser un proceso que demanda mucha energía; los albatros adultos, por ejemplo, pierden hasta 83 g de peso por día de incubación.201 El calor en la incubación de los huevos de los talégalos proviene del sol, de la descomposición de la vegetación o del calor del suelo en zonas volcánicas.202 Los períodos de incubación varían mucho, desde 10 días en los cucos, pájaros carpinteros y paseriformes, hasta más de 80 días en los albatros y en los kiwis.57
Cuidado paterno y emancipación

Una hembra de barnacla canadiense protege a sus polluelos de la lluvia.
La duración y naturaleza del cuidado parental varía mucho entre los diferentes órdenes y especies. En un extremo están los talégalos que dejan de cuidar a sus descendientes al romper el cascarón; el pollo recién nacido es capaz de salir del cascarón y del nido sin ayuda de los padres y valerse por sí mismo inmediatamente.204 En el otro extremo muchas aves marinas cuidan a sus pollos durante largos períodos; el más largo es el de la fragata grande, sus pollos tardan seis meses en emplumar y son alimentados por los padres durante otros catorce meses más.205

Familia de garzas cenizas, progenitores y pollos, en su nido.
El momento en que los pollos abandonan el nido varía de manera muy acusada. Los pollos de los álcidos del género Synthliboramphus, como el mérgulo antiguo, dejan el nido la noche después de salir del cascarón, siguen a sus padres al mar donde se desarrollan a salvo de los depredadores terrestres.209 Otras especies, como los patos, también abandonan el nido a una edad temprana. En la mayor parte de los casos, los pollos dejan el nido cuando son capaces de volar. Tras dejar el nido hay especies, por ejemplo los albatros, que no continúan cuidando de su nidada, mientras que otras siguen alimentándoles.210 Los juveniles pueden también seguir a sus padres durante su primera migración.211
Parasitismo de puesta
El parasitismo de puesta, en el que una especie deja sus huevos entre los de otra especie para que esta los críe, es más común entre las aves que en cualquier otro tipo de organismo.212 Después de que el ave parásita deposite sus huevos en el nido de otra, por lo general son aceptados y criados por los padres adoptivos a expensas de su propia nidada. Entre las especies que usan este modo de parasitismo hay unas que son incapaces de sacar adelante una nidada propia y por ello están obligadas a parasitar, y hay otras que en ocasiones ponen sus huevos en nidos de individuos de su misma especie para incrementar su rendimiento reproductivo, incluso aunque hayan criado a sus propios pollos.213 Unas cien especies, entre las que se incluyen indicadores, ictéridos, estríldidos y patos son parásitos obligados, aunque los más famosos son los cucos.212 En algunos parásitos de puesta sus huevos eclosionan antes que los del hospedador, lo que le permite al parásito destruir los huevos empujándolos fuera del nido o matar a los pollos que han tenido menos tiempo para desarrollarse; esto les asegura que toda la comida que traigan los padres-hospedadores sea para ellos.214Ecología
Las aves ocupan un amplio espectro de nichos ecológicos.170 Mientras algunas aves son generalistas, otras están altamente especializadas en su hábitat o en su alimentación. Incluso en un solo hábitat, como por ejemplo un bosque, los nichos ecológicos ocupados por diferentes aves varían; algunas especies se alimentan en la copa de los árboles, otras por debajo del dosel arbóreo, y algunas en el suelo del bosque. Las aves forestales pueden ser insectívoras, frugívoras y nectarívoras. Las aves acuáticas por lo general se alimentan pescando, comiendo plantas acuáticas, o como cleptoparásitas. Las aves de presa están especializadas en cazar mamíferos, otras aves y otros animales, mientras que los buitres son aves carroñeras especializadas.Algunas aves nectarívoras son importantes polinizadoras, y muchas especies frugívoras juegan un papel clave en la dispersión de las semillas.215 Las plantas y las aves que las polinizan, a menudo coevolucionan,216 y en algunos casos el principal polinizador de la planta es el único capaz de llegar a su néctar.217
Las aves son importantes en la ecología de las islas. Alcanzan islas adonde los mamíferos no han podido llegar; en estas islas las aves desempeñan roles ecológicos que en zonas continentales ocupan animales de mayor tamaño. Por ejemplo, en Nueva Zelanda las moas eran importantes ramoneadoras y frugívoras, como lo son el kereru y el kokako en la actualidad.215 Hoy en día las plantas en Nueva Zelanda mantienen las adaptaciones defensivas que desarrollaron para protegerse de las extintas moas.218 Las aves marinas también afectan la ecología de las islas en que nidifican, sobre todo a través de la concentración y acumulación de grandes cantidades de guano, que enriquecen con nutrientes los suelos,219 y los mares circundantes.220
Salud
Véase también: Anexo:Enfermedades de las aves en cautividad
Los parásitos más corrientes de las aves pertenecen a los grupos de los ácaros, los piojos aviares y los vermes. Otros parásitos microscópicos, como hongos, protozoos, bacterias y virus, también les provocan enfermedades.
Dermanyssus gallinae, un ácaro de las gallinas.
Los piojos de las aves (Ischnocera) infestan, la mayoría de ocasiones, a una especie concreta. Varias especies de platelmintos, entre los cuales están los cestodos, o los trematodos, pueden infectar las aves que los pueden transportar de un continente a otro. Por ejemplo, las aves marinas, al comer los berberechos, favorecen un parasitismo de trematodos (géneros Meiogymnophalus, Himasthla, etc.) que pueden luego afectar a varias especies de hospedadores, ya sean aves u otros moluscos.222
Además de parásitos, las aves pueden sufrir otras enfermedades infecciosas como:
|
Relación con el hombre

Caja de pájaro cantor autómata, un ejemplo del interés humano por esta clase del reino animal, en este caso emulando a la naturaleza con una versión mecánica.
Religión, folclore y cultura

El uso de cormoranes por pescadores asiáticos está en declive pronunciado, pero sobrevive en algunas áreas como atracción turística.
Las aves han sido representadas en la cultura y el arte desde tiempos prehistóricos, cuando eran pintadas en cuevas.233 Fueron usadas luego como arte y diseños religiosos o simbólicos, como el magnífico Trono del Pavo real de los Mogoles y los emperadores de Persia.234 Con el surgimiento del interés científico por las aves, muchas pinturas de aves fueron encargadas para libros. Uno de los pintores de aves más famoso fue John James Audubon, cuyas obras de aves norteamericanas tuvieron un gran éxito comercial en Europa, y quien luego prestó su nombre a la National Audubon Society.235 Las aves son también personajes importantes en la poesía; por ejemplo, Homero incorporó a los ruiseñores en su Odisea, y Cátulo usó al gorrión como un símbolo erótico en su Catullus 2.236
En español, existen algunos nombres de aves con sentido metafórico para describir o representar comportamientos y características humanas. Pero las percepciones de una misma ave a menudo varían entre distintas culturas. Los búhos se asocian con la mala suerte, la brujería y la muerte en zonas de África,237 pero son relacionados con la sabiduría en gran parte de Europa.238 Las abubillas eran consideras sagradas en el Egipto Antiguo, y símbolos de virtud en Persia, pero eran percibidas como ladronas en gran parte de Europa, y como presagio de guerra en Escandinavia.239
Importancia económica

Granja intensiva de gallinas.
Otros productos de aves comercialmente valiosos incluyen las plumas (especialmente el plumón de gansos y patos), usados en el aislamiento de ropas y acolchado de camas, y el guano (las heces de la aves), que es una rica fuente de fósforo y nitrógeno. La Guerra del Pacífico, llamada a veces Guerra del Guano, se libró en parte por el control de grandes depósitos de esta sustancia.244
Las aves han sido domesticadas por humanos como mascotas y para propósitos prácticos. Aves coloridas como los loros y las minas son criadas en cautiverio y mantenidas como animales de compañía, práctica que ha llevado al tráfico ilegal de algunas especies amenazadas.245 Los halcones y cormoranes han sido desde muy antiguo usados para la caza (cetrería) y la pesca respectivamente. La paloma mensajera, usada al menos desde el año 1 d.C, siguió siendo importante hasta épocas tan recientes como la Segunda Guerra Mundial. Hoy en día, tales actividades son más comunes como afición, entretenimiento, turismo,246 o deporte, como en las carreras de palomas.
Los entusiastas aficionados llamados observadores de aves o pajareros se cuentan por millones.247 Muchas personas disponen comederos de aves cerca de sus viviendas para atraer varias especies. La alimentación para aves se ha convertido en un negocio multimillonario. Por ejemplo, se estima que el 75% de las amas de casa de Gran Bretaña provee alimento para las aves en algún momento durante el invierno.248
Enfermedades transmitidas por aves
Las aves pueden jugar un rol sanitario importante al ser vectores de enfermedades humanas, al propagarlas a largas distancias, como la psitacosis, salmonelosis, campilobacteriosis, micobacteriosis (tuberculosis aviar), gripe aviar, giardiasis, y criptosporidiosis.249 Por ello estas zoonosis son estudiadas y su propagación es cuidadosamente vigilada. El descubrimiento de reservorios de enfermedades aviares puede llevar a las autoridades locales a tomar medidas radicales respecto a las aves de corral, lo cual puede representar un fuerte impacto económico. Así en septiembre de 2007, 205 000 aves fueron sacrificadas en Baviera,250 y otras 160 000 en Bangladés en junio de 2007,251 tras el descubrimiento de la cepa de la gripe aviar, entre otros ejemplos. Ciertas enfermedades pueden ser más específicas de un orden, como la enfermedad de Pacheco producida por un herpesvirus en Psittaciformes.252Conservación
Los humanos han tenido un gran impacto sobre muchas especies de aves. Las actividades humanas han permitido en algunos casos expandir drásticamente su territorio a algunas especies; otras, en cambio, han reducido su área de distribución, lo que ha conducido a muchas extinciones. Más de 120 especies de aves se han extinguido desde el siglo XVII,254 aunque las extinciones más dramáticas causadas por el hombre ocurrieron durante la colonización humana de las islas de Melanesia, Polinesia y Micronesia en el océano Pacífico, durante la cual se estima que se extinguieron de 750 a 1800 especies de aves.255 Muchas poblaciones de aves están en declive en todo el mundo; en condición de amenazadas se cuentan 1253 especies (año 2011) en las listas de Birdlife International y la UICN.5 La causa más frecuentemente citada involucra la pérdida de hábitat.256 Otras amenazas incluyen la caza excesiva, la mortalidad accidental por colisión con edificaciones o debida al enganche por la pesca con sedal largo,257 por contaminación (incluidos derrames de petróleo y uso de pesticidas),258 competencia y predación por especies invasoras (como ratas, gatos y mangostas),259 y el cambio climático. La familia que cuenta con más especies amenazadas (más de 70) es la de los loros. Los gobiernos, junto a organizaciones de conservación, trabajan para proteger a las aves mediante de leyes, preservando y restaurando sus hábitats, o manteniendo poblaciones en cautiverio para ulteriores reintroducciones. Los esfuerzos de conservación biológica han conseguido algunos éxitos; un estudio estimó que entre 1994 y 2004 fueron salvadas 16 especies de aves que se hubieran extinguido si no se hubieran realizado estas acciones.260Notas
- Ir a ↑ En esta ficha de taxón se siguen las directrices de la taxonomía clásica, es decir, usando las categorías linneanas, que establecen que Aves es una clase. Pero los estudios de la filogenética moderna (basados en clados) establecen que Aves proviene de Dinosauria.
Referencias
- Ir a ↑ ITIS. «Aves» (en inglés). Consultado el 6 de marzo de 2009.
- Ir a ↑ Brands, Sheila (14 de agosto de 2008). «Systema Naturae 2000 / Classification, Class Aves». Project: The Taxonomicon. Consultado el 6 de marzo de 2009.
- ↑ Saltar a: a b c Clements, James F. (2011). The Clements Checklist of Birds of the World (6ª edición). Ithaca: Cornell University Press. ISBN 978-0-8014-4501-9.
- Ir a ↑ Birdlife International. «Numerous bird species have been driven extinct» (en inglés). Consultado el 18 de agosto de 2012.
- ↑ Saltar a: a b Birdlife International. «Many bird species are close to extinction» (en inglés). Consultado el 7 de noviembre de 2011.
- Ir a ↑ Ver por ejemplo Richard O. Prum "Who's Your Daddy" Science 322 1799-1800, que citan también a R. O. Prum, Auk 119, 1 (2002).
- Ir a ↑ Paul, Gregory S. (2002). «Looking for the True Bird Ancestor». Dinosaurs of the Air: The Evolution and Loss of Flight in Dinosaurs and Birds. Baltimore: John Hopkins University Press. pp. 171–224. ISBN 0-8018-6763-0.
- Ir a ↑ Norell, Mark; Mick Ellison (2005). Unearthing the Dragon: The Great Feathered Dinosaur Discovery. New York: Pi Press. ISBN 0-13-186266-9.
- Ir a ↑ Turner, Alan H.; Pol, Diego; Clarke, Julia A.; Erickson, Gregory M.; and Norell, Mark (2007). «A basal dromaeosaurid and size evolution preceding avian flight» (PDF). Science 317: pp. 1378–1381. doi:. PMID 17823350. Consultado el 31 de marzo de 2009.
- Ir a ↑ Xing, X., Zhou, Z., Wang, X., Kuang, X., Zhang, F., and Du, X. (2003). «Four-winged dinosaurs from China». Nature 421 (6921): pp. 335–340. doi:.
- Ir a ↑ Thulborn, R.A. (1984). «The avian relationships of Archaeopteryx, and the origin of birds». Zoological Journal of the Linnean Society 82: pp. 119–158. doi:.
- Ir a ↑ Kurzanov, S.M. (1987). «Avimimidae and the problem of the origin of birds». Transactions of the joint Soviet - Mongolian Paleontological Expedition 31: pp. 31–94.
- Ir a ↑ Heilmann G. (1927). The Origin of Birds. Nueva York: Dover Publications.
- Ir a ↑ Rasskin-Gutman, Diego; Angela D. Buscalioni (marzo 2001). «Theoretical morphology of the Archosaur (Reptilia: Diapsida) pelvic girdle». Paleobiology 27 (1): pp. 59–78. doi:.
- Ir a ↑ Feduccia, Alan; Theagarten Lingham-Soliar, J. Richard Hinchliffe (noviembre 2005). «Do feathered dinosaurs exist? Testing the hypothesis on neontological and paleontological evidence». Journal of Morphology 266 (2): pp. 125–66. doi:. PMID 16217748.
- Ir a ↑ Esta teoría no es aceptada por la mayor parte de los paleontólogos Prum, Richard O. (abril 2003). «Are Current Critiques Of The Theropod Origin Of Birds Science? Rebuttal To Feduccia 2002». The Auk 120 (2): pp. 550–61. doi:. Consultado el 19 de abril de 2009.
- ↑ Saltar a: a b c d e Chiappe, Luis M. (2007). Glorified Dinosaurs: The Origin and Early Evolution of Birds. Sydney: University of New South Wales Press. ISBN 978-0-86840-413-4.
- Ir a ↑ Clarke, Julia A. (septiembre 2004). «Morphology, Phylogenetic Taxonomy, and Systematics of Ichthyornis and Apatornis (Avialae: Ornithurae)». Bulletin of the American Museum of Natural History 286: pp. 1–179. Consultado el 25 de abril de 2009.
- Ir a ↑ Clarke, Julia A.; Claudia P. Tambussi, Jorge I. Noriega, Gregory M. Erickson and Richard A. Ketcham (enero 2005). «Definitive fossil evidence for the extant avian radiation in the Cretaceous» (PDF). Nature 433: pp. 305–308. doi:. PMID 15662422. Consultado el 19 de abril de 2009. Información de soporte
- ↑ Saltar a: a b Ericson, Per G.P.; Cajsa L. Anderson, Tom Britton et ál. (diciembre 2006). «Diversification of Neoaves: Integration of molecular sequence data and fossils» (PDF). Biology Letters 2 (4): pp. 543–547. doi:. PMID 17148284. Consultado el 31 de marzo de 2009.
- Ir a ↑ Brown, Joseph W.; Robert B. Payne, David P. Mindell (junio 2007). «Nuclear DNA does not reconcile 'rocks' and 'clocks' in Neoaves: a comment on Ericson et ál.». Biology Letters 3 (3): pp. 257–259. doi:. PMID 17389215.
- ↑ Saltar a: a b c d Gary Ritchison. «Bird biogeography». Department of Biological Sciences Eastern Kentucky University. Consultado el 31 de marzo de 2009.
- Ir a ↑ Gill, Frank (2006). Birds of the World: Recommended English Names. Princeton: Princeton University Press. ISBN 978-0-691-12827-6.
- Ir a ↑ Darwin C. (1859). On the Origin of Species by Means of Natural Selection, or the Preservation of Favoured Races in the Struggle for Life. Londres: John Murray.
- Ir a ↑ Groth J.G. (1998). «Molecular phylogeny of the cardueline finches and Hawaiian honeycreepers». Ostrich 69: p. 401.
- Ir a ↑ Cibois, A.; Pasquet, E. & Schulenberg, T.S. (1999). «Molecular systematics of the Malagasy babblers (Timaliidae) and Warblers (Sylviidae), based on cytochrome b and 16S rRNA sequences». Mol. Phylogenet. Evol. 13 (3): pp. 581-595.
- Ir a ↑ Del Hoyo J., Elliott A. & Sargatal J. (1992). Handbook of the Birds of the World Vol 1. Barcelona: Lynx Edicions. ISBN 84-87334-10-5.
- Ir a ↑ Linnaeus, Carolus (1758). Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. Holmiae. (Laurentii Salvii).. pp. 824.
- ↑ Saltar a: a b c d e f g Livezey, Bradley C. & Zusi, Richard L. (2007). «Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion.». Zoological Journal of the Linnean Society 149 (1): pp. 1-95. Consultado el 29 de marzo de 2009.
- Ir a ↑ Padian, K. & L. M. Chiappe (1997). «Bird Origins». En Currie PJ & Padian K. Encyclopedia of Dinosaurs. San Diego: Academic Press. pp. 41-96.
- Ir a ↑ Gauthier, J. (1986). «Saurischian Monophyly and the origin of birds». En K. Padian. The Origin of Birds and the Evolution of Flight. Mem. California Acad. Sci 8. pp. 1-55.
- Ir a ↑ Giacchino A. (1999). «De los dinosaurios a las aves». Fundación de Historia Natural Félix de Azara. Consultado el 26 de abril de 2009.
- Ir a ↑ Chiappe L.M. & Vargas A. (2003). «Emplumando dinosaurios: la transición evolutiva de terópodos a aves». El Hornero 18 (1): pp. 1-11. ISSN 0073-3407. Consultado el 26 de abril de 2009.
- ↑ Saltar a: a b Hackett Shannon J. et ál. (27 de junio de 2008). «A Phylogenomic Study of Birds Reveals Their Evolutionary History». Science 320.
- Ir a ↑ Ericson, Per G.P.; Cajsa L. Anderson, Tom Britton et ál. (diciembre 2006). «Diversification of Neoaves: Integration of molecular sequence data and fossils» (PDF). Biology Letters 2 (4): pp. 543–547. doi:. PMID 17148284. Consultado el 31 de marzo de 2009.
- Ir a ↑ Fain, M. G., & P. Houde. (2004). «Parallel radiations in the primary clades of birds». Evolution 58 (11).
- Ir a ↑ Morgan-Richards M., Trewick S.A., Bartosch-Härlid A., Kardailsky O., Phillips M.J., McLenachan P.A., Penny D. (2008). «Bird evolution: testing the Metaves clade with six new mitochondrial genomes». BMC Evolutionary Biology 8 (20). doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Sibley, Charles; Jon Edward Ahlquist (1990). Phylogeny and classification of birds. New Haven: Yale University Press. ISBN 0-300-04085-7.
- Ir a ↑ Newton, Ian (2003). The Speciation and Biogeography of Birds. Amsterdam: Academic Press. pp. 463. ISBN 0-12-517375-X.
- Ir a ↑ Brooke, Michael (2004). Albatrosses And Petrels Across The World. Oxford University Press. ISBN 0-19-850125-0.
- Ir a ↑ Franco Zafra A.S. «El libro de los personajes alados de Colombia» (en español). Consultado el 31 de marzo de 2009.
- Ir a ↑ Lepage, Denis. «Checklist of birds of Colombia» (en inglés). Consultado el 31 de marzo de 2009.
- Ir a ↑ Barrie Heather & Hugh Robertson (1996). The Field Guide to the Birds of New Zealand. ISBN 0-670-86911-2.
- Ir a ↑ Lepage, Denis. «Checklist of birds of Madagascar» (en inglés). Consultado el 31 de marzo de 2009.
- Ir a ↑ Putting biodiversity on the map: priority areas for global conservation. 1992. ISBN 0-946888-24-8.
- Ir a ↑ Endemic Bird Areas of the World: Priorities for Biodiversity Conservation. 1998. ISBN 0-946888-33-7.
- Ir a ↑ Weir, Jason T.; Dolph Schluter (marzo 2007). «The Latitudinal Gradient in Recent Speciation and Extinction Rates of Birds and Mammals». Science 315 (5818): pp. 1574–76. doi:. PMID 17363673.
- ↑ Saltar a: a b Schreiber, Elizabeth Anne; Joanna Burger (2001). Biology of Marine Birds. Boca Raton: CRC Press. ISBN 0-8493-9882-7.
- Ir a ↑ Sato, Katsufumi; Y. Naito, A. Kato et ál. (mayo 2002). «Buoyancy and maximal diving depth in penguins: do they control inhaling air volume?». Journal of Experimental Biology 205 (9): pp. 1189–1197. PMID 11948196. Consultado el 19 de abril de 2009.
- Ir a ↑ Hill, David; Peter Robertson (1988). The Pheasant: Ecology, Management, and Conservation. Oxford: BSP Professional. ISBN 0-632-02011-3.
- Ir a ↑ Spreyer, Mark F.; Enrique H. Bucher (1998). «Monk Parakeet (Myiopsitta monachus)». Cornell Lab of OrnithologyThe Birds of North America. doi:10.2173/bna.322. Consultado el 19 de abril de 2009.
- Ir a ↑ Tala C., Guzmán P. y González S. (diciembre 2004). Servicio Agrícola y Ganadero – División de Protección de los Recursos Naturales Renovables. ed. «Cotorra argentina (Myiopsitta monachus) en Chile». Boletín DIPRODEN. Consultado el 19 de abril de 2009.
- Ir a ↑ Arendt, Wayne J. (1988). «Range Expansion of the Cattle Egret, (Bubulcus ibis) in the Greater Caribbean Basin». Colonial Waterbirds 11 (2): pp. 252–62. doi:.
- Ir a ↑ Bierregaard, R.O. (1994). «Yellow-headed Caracara». En Josep del Hoyo, Andrew Elliott & Jordi Sargatal (eds.). Handbook of the Birds of the World. Volume 2; New World Vultures to Guineafowl. Barcelona: Lynx Edicions. ISBN 84-87334-15-6.
- Ir a ↑ Juniper, Tony; Mike Parr (1998). Parrots: A Guide to the Parrots of the World. Londres: Christopher Helm. ISBN 0-7136-6933-0.
- Ir a ↑ Ehrlich, Paul R.; David S. Dobkin, and Darryl Wheye (1988). «Adaptations for Flight». Stanford UniversityBirds of Stanford. Consultado el 23 de marzo de 2009. Basado en The Birder's Handbook (Paul Ehrlich, David Dobkin, and Darryl Wheye. 1988. Simon and Schuster, New York.)
- ↑ Saltar a: a b c d e f g h i j k l m n ñ o p q r s t u v w x y z Gill, Frank (1995). Ornithology. New York: WH Freeman and Co. ISBN 0-7167-2415-4.
- Ir a ↑ «The Avian Skeleton». paulnoll.com. Consultado el 1 de mayo de 2009.
- Ir a ↑ «Skeleton of a typical bird». Fernbank Science Center's Ornithology Web. Consultado el 23 de marzo de 2009.
- Ir a ↑ Proctor, N.S. y P.J. Lynch (1993). Manual of ornithology: avian structure and function. Universidad de Yale.
- ↑ Saltar a: a b Brown R., Ferguson J., Lawrence M., Lees D. (2003). Huellas y señales de las aves de España y Europa. Ediciones Omega. ISBN 84-282-1338-0.
- Ir a ↑ Ehrlich, Paul R.; David S. Dobkin, and Darryl Wheye (1988). «Drinking». Standford UniversityBirds of Stanford. Consultado el 23 de marzo de 2009.
- Ir a ↑ Tsahar, Ella; Carlos Martínez del Rio, Ido Izhaki y Zeev Arad (2005). «Can birds be ammonotelic? Nitrogen balance and excretion in two frugivores». Journal of Experimental Biology 208 (6): pp. 1025–34. doi:. PMID 15767304. Consultado el 6 de julio de 2009.
- Ir a ↑ Preest, Marion R.; Carol A. Beuchat (abril 1997). «Ammonia excretion by hummingbirds». Nature 386: pp. 561–62. doi:.
- Ir a ↑ McWorther T.J., Martínez del Río C. & Powers D.R. (2003). «Are Hummingbirds Facultatively Ammonotelic? Nitrogen Excretion and Requirements as a Function of Body Size». Physiological and Biochemical Zoology 76 (5): pp. 731–743. doi:. Consultado el 6 de julio de 2009.
- Ir a ↑ Roxburgh L. & Pinshow B. (2002). «Ammonotely in a passerine nectarivore: the influence of renal and post-renal modification on nitrogenous waste product excretion». The Journal of Experimental Biology 205: pp. 1735-1745. PMID 12042332. Consultado el 6 de julio de 2009.
- Ir a ↑ Mora, J.; J. Martuscelli, Juana Ortiz-Pineda y G. Soberón (1965). «The Regulation of Urea-Biosynthesis Enzymes in Vertebrates» (PDF). Biochemical Journal 96: pp. 28–35. PMID 14343146. Consultado el 23 de marzo de 2009.
- Ir a ↑ Packard, Gary C. (1966). «The Influence of Ambient Temperature and Aridity on Modes of Reproduction and Excretion of Amniote Vertebrates». The American Naturalist 100 (916): pp. 667–82. doi:. Consultado el 23 de marzo de 2009.
- Ir a ↑ Balgooyen, Thomas G. (1971). «Pellet Regurgitation by Captive Sparrow Hawks (Falco sparverius)» (PDF). Condor 73 (3): pp. 382–85. doi:. Consultado el 23 de marzo de 2009.
- Ir a ↑ Gionfriddo, James P.; Louis B. Best (febrero 1995). «Grit Use by House Sparrows: Effects of Diet and Grit Size» (PDF). Condor 97 (1): pp. 57–67. doi:. Consultado el 23 de marzo de 2009.
- ↑ Saltar a: a b c Attenborough, David (1998). The Life of Birds. Princeton: Princeton University Press. ISBN 0-691-01633-X.
- Ir a ↑ Battley, Phil F.; Theunis Piersma, Maurine W. Dietz et ál. (enero 2000). «Empirical evidence for differential organ reductions during trans-oceanic bird flight». Proceedings of the Royal Society B 267 (1439): pp. 191–5. doi:. PMID 10687826. (Erratum in Proceedings of the Royal Society B 267(1461):2567.)
- ↑ Saltar a: a b Storer, Tracy I. y Usinger , Robert L. (1960). Zoología general.
- Ir a ↑ Maina, John N. (noviembre 2006). «Development, structure, and function of a novel respiratory organ, the lung-air sac system of birds: to go where no other vertebrate has gone». Biological Reviews 81 (4): pp. 545–79. PMID 17038201.
- ↑ Saltar a: a b Roderick A. Suthers; Sue Anne Zollinger (2004). «Producing song: the vocal apparatus». En H. Philip Zeigler & Peter Marler (eds.). Behavioral Neurobiology of Birdsong. Annals of the New York Academy of Sciences 1016. Nueva York: New York Academy of Sciences. pp. 109–129. doi:. pmid 15313772. ISBN 1-57331-473-0.
- Ir a ↑ Scott, Robert B (marzo 1966). «Comparative hematology: The phylogeny of the erythrocyte». Annals of Hematology 12 (6): pp. 340–51. doi:. PMID 5325853.
- Ir a ↑ Warham, John (1977). «The Incidence, Function and ecological significance of petrel stomach oils» (PDF). Proceedings of the New Zealand Ecological Society 24: pp. 84–93. doi:. Consultado el 23 de marzo de 2009.
- Ir a ↑ Dumbacher, J.P.; B.M. Beehler, T.F. Spande et ál. (octubre 1992). «Homobatrachotoxin in the genus Pitohui: chemical defense in birds?». Science 258 (5083): pp. 799–801. doi:. PMID 1439786.
- ↑ Saltar a: a b c d Ritchison, Gary. Nervous System: Brain and Special Senses II. Department of Biological Sciences Eastern Kentucky University. Consultado el 10 de abril de 2009.
- ↑ Saltar a: a b c d e f g Collectif (1974). Grande encyclopédie alpha des sciences et techniques, Zoologie tome II. París: Grange Batelière. pp. 13-15.
- Ir a ↑ Wilkie, Susan E.; Peter M. A. M. Vissers, Debipriya Das et ál. (1998). «The molecular basis for UV vision in birds: spectral characteristics, cDNA sequence and retinal localization of the UV-sensitive visual pigment of the budgerigar (Melopsittacus undulatus)». Biochemical Journal 330: pp. 541–47. PMID 9461554.
- Ir a ↑ Andersson, S. (1998). «Ultraviolet sexual dimorphism and assortative mating in blue tits». Proceeding of the Royal Society B 265 (1395): pp. 445–50. doi:.
- Ir a ↑ Viitala, Jussi; Erkki Korplmäki, Pälvl Palokangas & Minna Koivula (1995). «Attraction of kestrels to vole scent marks visible in ultraviolet light». Nature 373 (6513): pp. 425–27. doi:.
- Ir a ↑ Williams, David L.; Edmund Flach (marzo 2003). «Symblepharon with aberrant protrusion of the nictitating membrane in the snowy owl (Nyctea scandiaca)». Veterinary Ophthalmology 6 (1): pp. 11–13. doi:. PMID 12641836.
- Ir a ↑ White, Craig R.; Norman Day, Patrick J. Butler, Graham R. Martin (julio 2007). «Vision and Foraging in Cormorants: More like Herons than Hawks?». PLoS ONE 2 (7): pp. e639. doi:. PMID 17653266.
- Ir a ↑ Martin, Graham R.; Gadi Katzir (1999). «Visual fields in short-toed eagles, Circaetus gallicus (Accipitridae), and the function of binocularity in birds». Brain, Behaviour and Evolution 53 (2): pp. 55–66. doi:. PMID 9933782.
- Ir a ↑ Sales, James (2005). «The endangered kiwi: a review» (PDF). Folia Zoologica 54 (1–2): pp. 1–20. Consultado el 23 de marzo de 2009.
- Ir a ↑ Ehrlich, Paul R.; David S. Dobkin y Darryl Wheye (1988). «The Avian Sense of Smell». Standford UniversityBirds of Stanford. Consultado el 23 de marzo de 2009.
- Ir a ↑ Lequette, Benoit; Christophe Verheyden, Pierre Jouventin (agosto 1989). «Olfaction in Subantarctic seabirds: Its phylogenetic and ecological significance». The Condor 91 (3): pp. 732–35. doi:. Consultado el 23 de marzo de 2009.
- Ir a ↑ Nevitt G., Haberman K. (2003). «Behavioral attraction of Leach's storm-petrels (Oceanodroma leucorhoa) to dimethyl sulfide». The Journal of Experimental Biology 206: pp. 1497-1501. Consultado el 10 de abril de 2009.
- Ir a ↑ Nevitt G. (2008). «Sensory ecology on the high seas: the odor world of the procellariiform seabirds». The Journal of Experimental Biology 211: pp. 1706-1713. Consultado el 10 de abril de 2009.
- Ir a ↑ Saito, Nozomu (1978). «Physiology and anatomy of avian ear». The Journal of the Acoustical Society of America 64 (S1): pp. S3. doi:.
- ↑ Saltar a: a b Tanzarella S. & Mamecier A. (2005). Perception et communication chez les animaux. De Boeck Université. p. 109. ISBN 2-8041-4896-3. Consultado el 10 de abril de 2009.
- Ir a ↑ Wiltschko, W. & R. Wiltschko (2002). «Magnetic compass orientation in birds and its physiological basis». Naturwissenschaften 89: pp. 445-452.
- Ir a ↑ Göth, Anne (2007). «Incubation temperatures and sex ratios in Australian brush-turkey (Alectura lathami) mounds». Austral Ecology 32 (4): pp. 278–285. doi:.
- Ir a ↑ Göth, A. & Booth D.T. (2005). «Temperature-dependent sex ratio in a bird». Biology Letters 1 (1): pp. 31-33. doi:. Consultado el 1 de mayo de 2009.
- Ir a ↑ Young, J. Z. (1977). La vida de los vertebrados. Barcelona: Editorial Omega. ISBN 84-282-0206-0.
- Ir a ↑ Belthoff, James R.; Alfred M. Dufty, Jr., Sidney A. Gauthreaux, Jr. (agosto 1994). «Plumage Variation, Plasma Steroids and Social Dominance in Male House Finches». The Condor 96 (3): pp. 614–25. doi:.
- Ir a ↑ Guthrie, R. Dale. «How We Use and Show Our Social Organs». Body Hot Spots: The Anatomy of Human Social Organs and Behavior. Consultado el 31 de marzo de 2009.
- Ir a ↑ Humphrey, Philip S.; Kenneth C. Parkes (1959). «An approach to the study of molts and plumages» (PDF). The Auk 76: pp. 1–31. doi:. Consultado el 28 de marzo de 2009.
- ↑ Saltar a: a b c Pettingill Jr. OS (1970). Ornithology in Laboratory and Field. Burgess Publishing Co. ISBN 808716093.
- Ir a ↑ de Beer SJ, Lockwood GM, Raijmakers JHFS, Raijmakers JMH, Scott WA, Oschadleus HD, Underhill LG (2001). «SAFRING Bird Ringing Manual». SAFRING. Consultado el 28 de marzo de 2009.
- Ir a ↑ Gargallo, Gabriel (1994). «Flight Feather Moult in the Red-Necked Nightjar Caprimulgus ruficollis». Journal of Avian Biology 25 (2): pp. 119–24. doi:.
- Ir a ↑ Mayr, Ernst; Margaret Mayr (1954). «The tail molt of small owls» (PDF). The Auk 71 (2): pp. 172–78. Consultado el 28 de marzo de 2009.
- Ir a ↑ Payne, Robert B. «Birds of the World, Biology 532». Consultado el 28 de marzo de 2009.
- Ir a ↑ Turner, J. Scott (1997). «On the thermal capacity of a bird's egg warmed by a brood patch». Physiological Zoology 70 (4): pp. 470–80. doi:. PMID 9237308.
- Ir a ↑ Walther, Bruno A.; Dale H. Clayton (2005). «Elaborate ornaments are costly to maintain: evidence for high maintenance handicaps». Behavioural Ecology 16 (1): pp. 89–95. doi:.
- Ir a ↑ Shawkey, Matthew D.; Shawkey, Shreekumar R. Pillai, Geoffrey E. Hill (2003). «Chemical warfare? Effects of uropygial oil on feather-degrading bacteria». Journal of Avian Biology 34 (4): pp. 345–49. doi:.
- Ir a ↑ Ehrlich, Paul R.; David S. Dobkin, Darryl Wheye (1986). «The Adaptive Significance of Anting» (PDF). The Auk 103 (4): pp. 835. Consultado el 28 de marzo de 2009.
- Ir a ↑ Lucas, Alfred M. (1972). Avian Anatomy - integument. East Lansing, Michigan, USA: USDA Avian Anatomy Project, Michigan State University. pp. 67, 344, 394–601.
- Ir a ↑ Roots, Clive (2006). Flightless Birds. Westport: Greenwood Press. ISBN 978-0-313-33545-7.
- Ir a ↑ McNab, Brian K. (octubre 1994). «Energy Conservation and the Evolution of Flightlessness in Birds». The American Naturalist 144 (4): pp. 628–42. doi:. Consultado el 28 de marzo de 2009.
- Ir a ↑ Kovacs, Christopher E.; Ron A. Meyers (mayo 2000). «Anatomy and histochemistry of flight muscles in a wing-propelled diving bird, the Atlantic Puffin, Fratercula arctica». Journal of Morphology 244 (2): pp. 109–25. doi:.
- Ir a ↑ Garrido, O.H.; Kirkconnell, A. (2000). Birds of Cuba. Londres: Helm Field Guides. p. 253.
- Ir a ↑ Gundlach, J. (1893). Ornitología cubana. La Habana. pp. 132-133.
- Ir a ↑ Roots, C. (2006). Flightless Birds. Greenwood Press. p. 26. ISBN 0313335451. Consultado el 10 de abril de 2009.
- Ir a ↑ Amadon, D. (1947). «An estimated weight of the largest known bird». Condor 49: pp. 159-164.
- Ir a ↑ Davies, S.J.J.F. (2003). «Moas». En Hitchins, M.. Grzimek's Animal Life Encyclopedia. 8 Birds I Tinamous and Ratites to Hoatzins. Farmington Hills: MI: Gale Group. pp. 95-98. ISBN 0 7876 5784 0.
- Ir a ↑ Davies, S.J.J.F. (2003). «Elephant birds». En Hitchins, M.. Grzimek's Animal Life Encyclopedia. 8 Birds I Tinamous and Ratites to Hoatzins. Farmington Hills: MI: Gale Group. pp. 103-104. ISBN 0 7876 5784 0.
- Ir a ↑ Rich, P. (1979). «The Dromornithidae, an extinct family of large ground birds endemic to Australia». Bureau of National Resources, Geology and Geophysics Bulletin 184: pp. 1-196.
- Ir a ↑ Robertson, C. J. R. (2003). «Albatrosses (Diomedeidae)». En Hitchins, M.. Grzimek's Animal Life Encyclopedia. 8 Birds I Tinamous and Ratites to Hoatzins. Farmington Hills: MI: Gale Group. pp. 113-116, 118-119. ISBN 0 7876 5784 0.
- ↑ Saltar a: a b c Campbell, Kenneth E. Jr. & Tonni, E.P. (1983). «Size and locomotion in teratorns». Auk 100: pp. 390-403. Consultado el 10 de abril de 2009.
- Ir a ↑ Great Bustard Group. «The UK Great Bustard reintroduction project» (en inglés). Consultado el 10 de abril de 2009.
- Ir a ↑ Ferguson-Lees J. & Christie, D.A. (2001). Raptors of the World. Boston: Houghton Mifflin. ISBN 0-618-12762-30.
- Ir a ↑ K. N. Mouritsen (marzo 1994). «Day and Night Feeding in Dunlins Calidris alpina: Choice of Habitat, Foraging Technique and Prey». Journal of Avian Biology 25 (1): pp. 55-62. Consultado el 28 de marzo de 2009.
- Ir a ↑ Higgins, P.J. (1999). ZHandbook of Australian, New Zealand and Antarctic Birds. Volume 4: Parrots to Dollarbird. Melbourne: Oxford University Press. ISBN 0-19-553071-3.
- Ir a ↑ Jenni, L. & Winkler, R. Moult and Ageing of European passerines. Academic Press. ISBN 978-0123841506.
- Ir a ↑ Paul Rincon (22 de febrero de 2005). Crows and jays top bird IQ scale. BBC News. Consultado el 10 de abril de 2009.
- Ir a ↑ Bugnyar, T. & Kotrschal, K. (2002). «Observational learning and the raiding of food caches in ravens, Corvus corax: is it 'tactical' deception?». Animal Behaviour 64: pp. 185-195. Consultado el 10 de abril de 2009.
- Ir a ↑ Emery N.J. (2006). «Cognitive ornithology: the evolution of avian intelligence». Philos Trans. R. Soc. B 361: pp. 23-43. doi:. Consultado el 10 de abril de 2009.
- Ir a ↑ Munn, C.A. «Macaw and Parrot Clay Licks» (en inglés). Consultado el 10 de abril de 2009.
- Ir a ↑ Watve M., Thakar J., Kale A., Pitambekar S., Shaikh I., Vaze K, Jog M. Paranjape S. (diciembre 2002). «Bee-eaters (Merops orientalis) respond to what a predator can see». Animal Cognition 5 (4): pp. 253-259. PMID 12461603. Consultado el 10 de abril de 2009.
- Ir a ↑ Robert, Michel; Raymond McNeil, Alain Leduc (enero 1989). «Conditions and significance of night feeding in shorebirds and other water birds in a tropical lagoon» (PDF). The Auk 106 (1): pp. 94–101. Consultado el 19 de abril de 2009.
- Ir a ↑ Paton, D. C.; B. G. Collins (1989). «Bills and tongues of nectar-feeding birds: A review of morphology, function, and performance, with intercontinental comparisons». Australian Journal of Ecology 14 (4): pp. 473–506. doi:.
- Ir a ↑ Baker, Myron Charles; Ann Eileen Miller Baker (1973). «Niche Relationships Among Six Species of Shorebirds on Their Wintering and Breeding Ranges». Ecological Monographs 43 (2): pp. 193–212. doi:.
- Ir a ↑ Cherel, Yves; Pierrick Bocher, Claude De Broyer et ál. (2002). «Food and feeding ecology of the sympatric thin-billed Pachyptila belcheri and Antarctic P. desolata prions at Iles Kerguelen, Southern Indian Ocean». Marine Ecology Progress Series 228: pp. 263–81. doi:.
- Ir a ↑ Jenkin, Penelope M. (1957). «The Filter-Feeding and Food of Flamingoes (Phoenicopteri)». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 240 (674): pp. 401–93. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Miyazaki, Masamine (julio 1996). «Vegetation cover, kleptoparasitism by diurnal gulls and timing of arrival of nocturnal Rhinoceros Auklets» (PDF). The Auk 113 (3): pp. 698–702. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Bélisle, Marc; Jean-François Giroux (agosto 1995). «Predation and kleptoparasitism by migrating Parasitic Jaegers» (PDF). The Condor 97 (3): pp. 771–781. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Vickery, J. A.; M. De L. Brooke (mayo 1994). «The Kleptoparasitic Interactions between Great Frigatebirds and Masked Boobies on Henderson Island, South Pacific» (PDF). The Condor 96 (2): pp. 331–40. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Hiraldo, F.C.; J.C. Blanco y J. Bustamante (1991). «Unspecialized exploitation of small carcasses by birds». Bird Studies 38 (3): pp. 200–07.
- Ir a ↑ Engel, Sophia Barbara (2005). Racing the wind: Water economy and energy expenditure in avian endurance flight. University of Groningen. ISBN 90-367-2378-7. Consultado el 19 de abril de 2009.
- Ir a ↑ Tieleman, B.I.; J.B. Williams (1999). «The role of hyperthermia in the water economy of desert birds». Physiol. Biochem. Zool. 72: pp. 87–100.
- Ir a ↑ Schmidt-Nielsen, Knut (1960). «The Salt-Secreting Gland of Marine Birds». Circulation 21: pp. 955–967. Consultado el 19 de abril de 2009.
- Ir a ↑ Hallager, Sara L. (1994). «Drinking methods in two species of bustards». Wilson Bull. 106 (4): pp. 763–764. Consultado el 19 de abril de 2009.
- Ir a ↑ MacLean, Gordon L. (1983). «Water Transport by Sandgrouse». BioScience 33 (6): pp. 365–369.
- Ir a ↑ Battley, Phil F.; Theunis Piersma, Maurine W. Dietz et ál. (enero 2000). «Empirical evidence for differential organ reductions during trans-oceanic bird flight». Proceedings of the Royal Society B 267 (1439): pp. 191–5. doi:. PMID 10687826. (Erratum in Proceedings of the Royal Society B 267(1461):2567.)
- Ir a ↑ Klaassen, Marc (1996). «Metabolic constraints on long-distance migration in birds». Journal of Experimental Biology 199 (1): pp. 57–64. PMID 9317335. Consultado el 19 de abril de 2009.
- Ir a ↑ Long-distance Godwit sets new record. BirdLife International. 4 de mayo de 2007. Consultado el 19 de abril de 2009.
- Ir a ↑ Shaffer, Scott A.; Yann Tremblay, Henri Weimerskirch et ál (2006). «Migratory shearwaters integrate oceanic resources across the Pacific Ocean in an endless summer». Proceedings of the National Academy of Sciences 103 (34): pp. 12799–802. doi:. PMID 16908846.
- Ir a ↑ Croxall, John P.; Janet R. D. Silk, Richard A. Phillips et ál. (2005). «Global Circumnavigations: Tracking year-round ranges of nonbreeding Albatrosses». Science 307 (5707): pp. 249–50. doi:. PMID 15653503.
- Ir a ↑ Wilson, W. Herbert, Jr. (1999). «Bird feeding and irruptions of northern finches:are migrations short stopped?» (PDF). North America Bird Bander 24 (4): pp. 113–21. Consultado el 19 de abril de 2009.
- Ir a ↑ Nilsson, Anna L. K.; Thomas Alerstam y Jan-Åke Nilsson (2006). «Do partial and regular migrants differ in their responses to weather?». The Auk 123 (2): pp. 537–47. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Chan, Ken (2001). «Partial migration in Australian landbirds: a review». Emu 101 (4): pp. 281–92. doi:.
- Ir a ↑ Rabenold, Kerry N.; Patricia Parker Rabenold (1985). «Variation in Altitudinal Migration, Winter Segregation, and Site Tenacity in two subspecies of Dark-eyed Juncos in the southern Appalachians» (PDF). The Auk 102 (4): pp. 805–19. Consultado el 19 de abril de 2009.
- Ir a ↑ Collar, Nigel J. (1997). «Family Psittacidae (Parrots)». En Josep del Hoyo, Andrew Elliott & Jordi Sargatal (eds.). Handbook of the Birds of the World, Volume 4: Sandgrouse to Cuckoos. Barcelona: Lynx Edicions. ISBN 84-87334-22-9.
- Ir a ↑ Matthews, G. V. T. (1953). «Navigation in the Manx Shearwater». Journal of Experimental Biology 30 (2): pp. 370–96. Consultado el 19 de abril de 2009.
- Ir a ↑ Mouritsen, Henrik; Ole Næsbye Larsen (2001). «Migrating songbirds tested in computer-controlled Emlen funnels use stellar cues for a time-independent compass». Journal of Experimental Biology 204 (8): pp. 3855–65. PMID 11807103. Consultado el 19 de abril de 2009.
- Ir a ↑ Deutschlander, Mark E.; John B. Phillips y S. Chris Borland (1999). «The case for light-dependent magnetic orientation in animals». Journal of Experimental Biology 202 (8): pp. 891–908. PMID 10085262. Consultado el 19 de abril de 2009.
- Ir a ↑ Möller, Anders Pape (1988). «Badge size in the house sparrow Passer domesticus». Behavioral Ecology and Sociobiology 22 (5): pp. 373–78.
- Ir a ↑ Thomas, Betsy Trent; Stuart D. Strahl (1990). «Nesting Behavior of Sunbitterns (Eurypyga helias) in Venezuela» (PDF). The Condor 92 (3): pp. 576–81. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Pickering, S. P. C.; S. D. Berrow (2001). «Courtship behaviour of the Wandering Albatross Diomedea exulans at Bird Island, South Georgia» (PDF). Marine Ornithology 29 (1): pp. 29–37. Consultado el 19 de abril de 2009.
- Ir a ↑ Pruett-Jones, S. G.; M. A. Pruett-Jones (mayo 1990). «Sexual Selection Through Female Choice in Lawes' Parotia, A Lek-Mating Bird of Paradise». Evolution 44 (3): pp. 486–501. doi:.
- Ir a ↑ Genevois, F.; V. Bretagnolle (1994). «Male Blue Petrels reveal their body mass when calling». Ethology Ecology and Evolution 6 (3): pp. 377–83. Consultado el 19 de abril de 2009.
- Ir a ↑ Jouventin, Pierre; Thierry Aubin y Thierry Lengagne (1999). «Finding a parent in a king penguin colony: the acoustic system of individual recognition». Animal Behaviour 57 (6): pp. 1175–83. doi:. PMID 10373249.
- Ir a ↑ Templeton, Christopher N.; Greene, Erick y Davis, Kate (2005). «Allometry of Alarm Calls: Black-Capped Chickadees Encode Information About Predator Size». Science 308 (5730): pp. 1934–37. doi:. PMID 15976305.
- Ir a ↑ Schwarz, J. (19 de marzo de 2007). Eavesdropping nuthatches distinguish danger threats in chickadee alarm calls. University of Washington News. Consultado el 3 de mayo de 2009.
- Ir a ↑ Miskelly, C. M. (julio 1987). «The identity of the hakawai» (PDF). Notornis 34 (2): pp. 95–116. Consultado el 19 de abril de 2009.
- Ir a ↑ Murphy, Stephen; Sarah Legge y Robert Heinsohn (2003). «The breeding biology of palm cockatoos (Probosciger aterrimus): a case of a slow life history». Journal of Zoology 261 (4): pp. 327–39. doi:.
- ↑ Saltar a: a b Sekercioglu, Cagan Hakki (2006). «Foreword». En Josep del Hoyo, Andrew Elliott & David Christie (eds.). Handbook of the Birds of the World, Volume 11: Old World Flycatchers to Old World Warblers. Barcelona: Lynx Edicions. pp. 48. ISBN 84-96553-06-X.
- Ir a ↑ Terborgh, John (2005). «Mixed flocks and polyspecific associations: Costs and benefits of mixed groups to birds and monkeys». American Journal of Primatology 21 (2): pp. 87–100. doi:.
- Ir a ↑ Hutto, Richard L. (enero 1988). «Foraging Behavior Patterns Suggest a Possible Cost Associated with Participation in Mixed-Species Bird Flocks». Oikos 51 (1): pp. 79–83. doi:.
- Ir a ↑ Au, David W. K.; Robert L. Pitman (agosto 1986). «Seabird interactions with Dolphins and Tuna in the Eastern Tropical Pacific» (PDF). The Condor 88 (3): pp. 304–17. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Anne, O.; E. Rasa (junio 1983). «Dwarf mongoose and hornbill mutualism in the Taru desert, Kenya». Behavioral Ecology and Sociobiology 12 (3): pp. 181–90. doi:.
- Ir a ↑ Gauthier-Clerc, Michael; Alain Tamisier, Frank Cezilly (mayo 2000). «Sleep-Vigilance Trade-off in Gadwall during the Winter Period» (PDF). The Condor 102 (2): pp. 307–13. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Bäckman, Johan (2002). «Harmonic oscillatory orientation relative to the wind in nocturnal roosting flights of the swift Apus apus». The Journal of Experimental Biology 205: pp. 905–910. Consultado el 19 de abril de 2009.
- Ir a ↑ Rattenborg, Niels C. (2006). «Do birds sleep in flight?». Die Naturwissenschaften 93 (9): pp. 413–25. doi:.
- Ir a ↑ Milius, S. (1999). «Half-asleep birds choose which half dozes». Science News Online 155: pp. 86. doi:. Archivado del original el 2012-05-29. Consultado el 19 de abril de 2009.
- Ir a ↑ Beauchamp, Guy (1999). «The evolution of communal roosting in birds: origin and secondary losses». Behavioural Ecology 10 (6): pp. 675–87. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Buttemer, William A. (1985). «Energy relations of winter roost-site utilization by American goldfinches (Carduelis tristis)» (PDF). Oecologia 68 (1): pp. 126–32. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Buckley, F. G.; P. A. Buckley (1968). «Upside-down Resting by Young Green-Rumped Parrotlets (Forpus passerinus)». The Condor 70 (1): pp. 89. doi:.
- Ir a ↑ Carpenter, F. Lynn (1974). «Torpor in an Andean Hummingbird: Its Ecological Significance». Science 183 (4124): pp. 545–47. doi:. PMID 17773043.
- Ir a ↑ McKechnie, Andrew E.; Robert A. M. Ashdown, Murray B. Christian and R. Mark Brigham (2007). «Torpor in an African caprimulgid, the freckled nightjar Caprimulgus tristigma». Journal of Avian Biology 38 (3): pp. 261–66. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Jr.Cleveland P Hickman, Larry S. Roberts, Allan L. Larson (2001) (en inglés). Integrated Principles of Zoology. McGraw-Hill Publishing Co. ISBN 0–07–290961–7.
- Ir a ↑ Warnock, Nils & Sarah (2001). «Sandpipers, Phalaropes and Allies». En Chris Elphick, John B. Dunning, Jr & David Sibley (en inglés). The Sibley Guide to Bird Life and Behaviour. Londres: Christopher Helm. ISBN 0-7136-6250-6.
- Ir a ↑ Freed, Leonard A. (1987). «The Long-Term Pair Bond of Tropical House Wrens: Advantage or Constraint?». The American Naturalist 130 (4): pp. 507–25. doi:.
- Ir a ↑ Gowaty, Patricia A. (1983). «Male Parental Care and Apparent Monogamy among Eastern Bluebirds(Sialia sialis)». The American Naturalist 121 (2): pp. 149–60. doi:.
- Ir a ↑ Westneat, David F.; Ian R. K. Stewart (2003). «Extra-pair paternity in birds: Causes, correlates, and conflict». Annual Review of Ecology, Evolution, and Systematics 34: pp. 365–96. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Gowaty, Patricia A.; Nancy Buschhaus (1998). «Ultimate causation of aggressive and forced copulation in birds: Female resistance, the CODE hypothesis, and social monogamy». American Zoologist 38 (1): pp. 207–25. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Sheldon, B (1994). «Male Phenotype, Fertility, and the Pursuit of Extra-Pair Copulations by Female Birds». Proceedings: Biological Sciences 257 (1348): pp. 25–30. doi:.
- Ir a ↑ Wei, G; Z Yin, F Lei (2005). «Copulations and mate guarding of the Chinese Egret». Waterbirds 28 (4): pp. 527–30. doi:.
- Ir a ↑ Short, Lester L. (1993). Birds of the World and their Behavior. New York: Henry Holt and Co. ISBN 0-8050-1952-9.
- Ir a ↑ Frith, Clifford B. & Beehler, Bruce M. (1998) (en inglés). The Birds of Paradise: Paradisaeidae. Oxford University Press. ISBN 0-19-854853-2.
- Ir a ↑ Snow, D. W. (2004). «Family Pipridae (Manakins)». En del Hoyo, J., Elliott, A., & Christie, D. A. (en inglés). Handbook of the Birds of the World. Vol. 9. Cotingas to Pipits and Wagtails. Barcelona: Lynx Edicions. pp. 110-169. ISBN 84-87334-69-5.
- Ir a ↑ Burton, R (1985). Bird Behaviour. Alfred A. Knopf, Inc. ISBN 0-394-53857-5.
- Ir a ↑ Schamel, D; DM Tracy, DB Lank, DF Westneat (2004). «Mate guarding, copulation strategies and paternity in the sex-role reversed, socially polyandrous red-necked phalarope Phalaropus lobatus» (PDF). Behaviour Ecology and Sociobiology 57 (2): pp. 110–18. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Kokko H., Harris M., Wanless S. (2004). «Competition for breeding sites and site-dependent population regulation in a highly colonial seabird, the common guillemot Uria aalge.» (en inglés). Journal of Animal Ecology 73 (2): pp. 367-376. doi:.
- Ir a ↑ Booker L., Booker M. (1991). «Why Are Cuckoos Host Specific?» (en inglés). Oikos 57 (3): pp. 301-309. doi:.
- ↑ Saltar a: a b Hansell M. (2000) (en inglés). Bird Nests and Construction Behaviour. University of Cambridge Press. ISBN 0-521-46038-7.
- Ir a ↑ Lafuma L., Lambrechts M., Raymond M. (2001). «Aromatic plants in bird nests as a protection against blood-sucking flying insects?» (en inglés). Behavioural Processes 56 (2): pp. 113-120. doi:.
- Ir a ↑ Warham, J. (1990) (en inglés). The Petrels - Their Ecology and Breeding Systems. Londres: Academic Press. ISBN 0127354204.
- Ir a ↑ Jones DN, Dekker, René WRJ, Roselaar, Cees S. (1995) (en inglés). The Megapodes. Bird Families of the World 3.. Oxford: Oxford University Press. ISBN 0-19-854651-3.
- Ir a ↑ Duellman, William E.; Linda Trueb (1994) (en inglés). Biology of Amphibians. Johns Hopkins University Press. ISBN 978-0-8018-4780-6.
- Ir a ↑ Elliott A. (1994). «Family Megapodiidae (Megapodes)». Handbook of the Birds of the World, Volume 2: New World Vultures to Guineafowl (Barcelona: Lynx Edicions). ISBN 84-873337-15-6.
- Ir a ↑ Metz V.G., Schreiber E.A. (2002). «Great Frigatebird (Fregata minor)». En Poole, A. & Gill, F. (en inglés). The Birds of North America, No 681. Filadelfia: The Birds of North America Inc. ISBN 0-85661-135-2.
- Ir a ↑ Ekman J. (2006). «Family living amongst birds.» (en inglés). Journal of Avian Biology 37 (4): pp. 289-298. doi:.
- Ir a ↑ Cockburn A (1996). «Why do so many Australian birds cooperate? Social evolution in the Corvida». En Floyd R., Sheppard A., de Barro P.. Frontiers in Population Ecology. Melbourne: CSIRO. pp. 21–42.
- Ir a ↑ Cockburn, Andrew (2006). «Prevalence of different modes of parental care in birds». Proceedings: Biological Sciences 273 (1592): pp. 1375–83. doi:. PMID 16777726.
- Ir a ↑ Gaston A.J. (1994). «Ancient Murrelet (Synthliboramphus antiquus)». En Poole, A. & Gill, F. (en inglés). The Birds of North America, No 132. Filadelfia y Washington, D.C.: The Academy of Natural Sciences & The American Ornithologists Union.
- Ir a ↑ Schaefer HC, Eshiamwata GW, Munyekenye FB, Bohning-Gaese K (2004). «Life-history of two African Sylvia warblers: low annual fecundity and long post-fledging care.» (en inglés). Ibis 146 (3): pp. 427-437. doi:.
- Ir a ↑ Alonso JC, Bautista LM, Alonso JA (2004). «Family-based territoriality vs flocking in wintering common cranes Grus grus.» (en inglés). Journal of Avian Biology 35 (5): pp. 434-444. doi:.
- ↑ Saltar a: a b Davies N. (2000) (en inglés). Cuckoos, Cowbirds and other Cheats. Londres: T. & A. D. Poyser. ISBN 0-85661-135-2.
- Ir a ↑ Sorenson M. (1997). «Effects of intra- and interspecific brood parasitism on a precocial host, the canvasback, Aythya valisineria.» (en inglés). Behavioral Ecology 8 (2): pp. 153-161. Consultado el 19 de abril de 2009.
- Ir a ↑ Spottiswoode C., Colebrook-Robjent J. (2007). «Egg puncturing by the brood parasitic Greater Honeyguide and potential host counteradaptations.» (en inglés). Behavioral Ecology 18 (4): pp. 792-799. doi:. Consultado el 19 de abril de 2009.
- ↑ Saltar a: a b Clout M. & Hay J. (1989). «The importance of birds as browsers, pollinators and seed dispersers in New Zealand forests.» (en inglés). New Zealand Journal of Ecology 12: pp. 27-33. Consultado el 19 de abril de 2009.
- Ir a ↑ Stiles F. (1981). «Geographical Aspects of Bird–Flower Coevolution, with Particular Reference to Central America.» (en inglés). Annals of the Missouri Botanical Garden 68 (2): pp. 323-351. doi:.
- Ir a ↑ Temeles E., Linhart Y., Masonjones M., Masonjones H. (2002). «The Role of Flower Width in Hummingbird Bill Length–Flower Length Relationships.» (en inglés). Biotropica 34 (1): pp. 68-80. Consultado el 19 de abril de 2009.
- Ir a ↑ Bond W., Lee W., Craine J. (2004). «Plant structural defences against browsing birds: a legacy of New Zealand's extinct moas.» (en inglés). Oikos 104 (3): pp. 500-508. doi:.
- Ir a ↑ Wainright S., Haney J., Kerr C., Golovkin A., Flint M. (abril 1998). «Utilization of nitrogen derived from seabird guano by terrestrial and marine plants at St. Paul, Pribilof Islands, Bering Sea, Alaska.» (en inglés). Marine Ecology 131 (1): pp. 63-71. doi:. Consultado el 19 de abril de 2009.
- Ir a ↑ Bosman A. & Hockey A. (1986). «Seabird guano as a determinant of rocky intertidal community structure.» (en inglés). Marine Ecology Progress Series 32: pp. 247-257. Consultado el 19 de abril de 2009.
- ↑ Saltar a: a b c Ritchison, Gary (en inglés). Avian Reproduction: Nests. Department of Biological Sciences Eastern Kentucky University. Consultado el 28 de marzo de 2009.
- Ir a ↑ Dabouineau L., Oubella R., Le Goff C. Université Catholique de l’Ouest (ed.): «Les Pathogènes parasites des coques» (en francés). Consultado el 24 de abril de 2009.
- Ir a ↑ Bonney, Rick; Rohrbaugh, Jr., Ronald (2004). Handbook of Bird Biology (2ª edición). Princeton, NJ: Princeton University Press. ISBN 0-938-02762-X.
- Ir a ↑ Dean W., Siegfried R., MacDonald I. (1990). «The Fallacy, Fact, and Fate of Guiding Behavior in the Greater Honeyguide» (en inglés). Conservation Biology 4 (1): pp. 99-101. doi:. Consultado el 21 de abril de 2009.
- Ir a ↑ Singer R., Yom-Tov Y. (1988). «The Breeding Biology of the House Sparrow Passer domesticus in Israel.» (en inglés). Ornis Scandinavica 19: pp. 139-144. doi:.
- Ir a ↑ Dolbeer R. (1990). «Ornithology and integrated pest management: Red-winged blackbirds Agleaius phoeniceus and corn.» (en inglés). Ibis 132 (2): pp. 309-322.
- Ir a ↑ Dolbeer R., Belant J., Sillings J. (1993). «Shooting Gulls Reduces Strikes with Aircraft at John F. Kennedy International Airport» (en inglés). Wildlife Society Bulletin 21: pp. 442-450.
- Ir a ↑ Routledge S., Routledge K. (1917). «The Bird Cult of Easter Island» (en inglés). Folklore 28 (4): pp. 337-355.
- Ir a ↑ Chappell J. (2006). «Living with the Trickster: Crows, Ravens, and Human Culture» (en inglés). PLoS Biol 4 (1:e14). doi:. Consultado el 21 de abril de 2009.
- Ir a ↑ Hauser A. (1985). «Jonah: In Pursuit of the Dove» (en inglés). Journal of Biblical Literature 104 (1): pp. 21-37. doi:.
- Ir a ↑ Nair P. (1974). «The Peacock Cult in Asia» (en inglés). Asian Folklore Studies 33 (2): pp. 93-170. doi:.
- Ir a ↑ Tennyson A., Martinson P. (2006). Extinct Birds of New Zealand. Wellington: Te Papa Press. ISBN 978-0-909010-21-8.
- Ir a ↑ Meighan C. (1966). «Prehistoric Rock Paintings in Baja California» (en inglés). American Antiquity 31 (3): pp. 372-392. doi:.
- Ir a ↑ Clarke C.P. (1908). «A Pedestal of the Platform of the Peacock Throne» (en inglés). The Metropolitan Museum of Art Bulletin 3 (10): pp. 182-183. doi:.
- Ir a ↑ Boime A. (1999). «John James Audubon, a birdwatcher's fanciful flights» (en inglés). Art History 22 (5): pp. 728-755. doi:.
- Ir a ↑ Chandler A. (1934). «The Nightingale in Greek and Latin Poetry» (en inglés). The Classical Journal 30 (2): pp. 78-84.
- Ir a ↑ Enriquez P.L., Mikkola H. (1997). «Comparative study of general public owl knowledge in Costa Rica, Central America and Malawi, Africa». En J.R. Duncan, D.H. Johnson, T.H. Nicholls (en inglés). Biology and conservation of owls of the Northern Hemisphere. General Technical Report NC-190. St. Paul, Minnesota: USDA Forest Service. pp. 160-166.
- Ir a ↑ Lewis D.P. «Owls in Mythology and Culture» (en inglés). The Owl Pages. Consultado el 24 de abril de 2009.
- Ir a ↑ Dupree N. (1974). «An Interpretation of the Role of the Hoopoe in Afghan Folklore and Magic» (en inglés). Folklore 85 (3): pp. 173-193.
- Ir a ↑ Lester B.R. «Shifting protein sources: Chapter 3: Moving Up the Food Chain Efficiently» (en inglés). Earth Policy Institute. Consultado el 24 de abril de 2009.
- Ir a ↑
- Ir a ↑ Hamilton S. (2000). «How precise and accurate are data obtained using. an infra-red scope on burrow-nesting sooty shearwaters Puffinus griseus?» (en inglés). Marine Ornithology 28 (1): pp. 1-6. Consultado el 24 de abril de 2009.
- Ir a ↑ Keane A., Brooke M.D., Mcgowan P.J.K. (2005). «Correlates of extinction risk and hunting pressure in gamebirds (Galliformes)» (en inglés). Biological Conservation 126 (2): pp. 216-233. doi:.
- Ir a ↑ World History at KMLA. «The Guano War of 1865-1866» (en inglés). Consultado el 24 de abril de 2009.
- Ir a ↑ Cooney R., Jepson P. (2006). «The international wild bird trade: what's wrong with blanket bans?» (en inglés). Oryx 40 (1): pp. 18-23. doi:. Consultado el 24 de abril de 2009.
- Ir a ↑ Manzi M. (2002). «Cormorant fishing in Southwestern China: a Traditional Fishery under Siege. (Geographical Field Note)» (en inglés). Geographic Review 92 (4): pp. 597-603. doi:. Archivado del original el 2012-05-29. Consultado el 24 de abril de 2009.
- Ir a ↑ Pullis La Rouche, G. (2006). «Birding in the United States: a demographic and economic analysis». En G.C. Boere, C.A. Galbraith & D.A. Stroud (en inglés). Waterbirds around the world. Edimburgo: The Stationery Office. pp. 841-846. doi:. ISBN 0 11 497333 4.
- Ir a ↑ Chamberlain D.E., Vickery J.A., Glue D.E., Robinson R.A., Conway G.J., Woodburn R.J.W., Cannon A.R. (2005). «Annual and seasonal trends in the use of garden feeders by birds in winter» (en inglés). Ibis 147 (3): pp. 563-575. doi:. Consultado el 24 de abril de 2009.
- Ir a ↑ Reed, Kurt D. Jennifer K. Meece, James S. Henkel, et Sanjay K. Shukla (2003). «Birds, Migration and Emerging Zoonoses: West Nile Virus, Lyme Disease, Influenza A and Enteropathogens» (en inglés). Clinical Medicine and Research 1 (1): pp. 5-12. Consultado el 28 de marzo de 2009.
- Ir a ↑ Planète mag (10 de septiembre de 2007) (en francés). Grippe aviaire : 205.000 canards abattus en Allemagne. Consultado el 28 de marzo de 2009.
- Ir a ↑ Diariosalud.net (11 de junio de 2007). Decimoquinta muerte por gripe aviar en Egipto. Consultado el 28 de marzo de 2009.
- Ir a ↑ AnimauxExotiques.com. «Maladie de pachéco». Consultado el 10 de abril de 2009.
- Ir a ↑ Mussen, D (5 de marzo de 2009). «Kakapo back to nest after 21 years» (en inglés). Sunday Star-Times. Consultado el 20 de abril de 2009.
- Ir a ↑ Fuller E. (2000). Extinct Birds. Nueva York: Oxford University Press. ISBN 0-19-850837-9.
- Ir a ↑ Steadman D. (2006). Extinction and Biogeography in Tropical Pacific Birds. University of Chicago Press. ISBN 978-0-226-77142-7.
- Ir a ↑ Norris K., Pain D. (2002). Conserving Bird Biodiversity: General Principles and their Application. Cambridge University Press. ISBN 978-0-521-78949-3.
- Ir a ↑ Brothers N.P. (1991). «Albatross mortality and associated bait loss in the Japanese longline fishery in the southern ocean». Biological Conservation 55: pp. 255-268.
- Ir a ↑ Wurster D., Wurster C., Strickland W. (abril 1965). «Bird Mortality Following DDT Spray for Dutch Elm Disease» (en inglés). Ecology 46 (4): pp. 488-499. doi:. Consultado el 10 de abril de 2009.
- Ir a ↑ Blackburn T., Cassey P., Duncan R., Evans K., Gaston K. (2004). «Avian Extinction and Mammalian Introductions on Oceanic Islands». Science 305: pp. 1955-1958.
- Ir a ↑ Butchart S., Stattersfield A., Collar N. (julio 2006). «How many bird extinctions have we prevented?» (en inglés). Oryx 40 (3): pp. 266-279. Consultado el 10 de abril de 2009.
Anura
(Redirigido desde «Rana»)
| Anuros | |
|---|---|
| Rango temporal: Triásico Inferior - Presente | |
 Litoria subglandulosa |
|
| Clasificación científica | |
| Reino: | Animalia |
| Subreino: | Eumetazoa |
| Superfilo: | Deuterostomia |
| Filo: | Chordata |
| Subfilo: | Vertebrata |
| Infrafilo: | Gnathostomata |
| Superclase: | Tetrapoda |
| Clase: | Amphibia |
| Subclase: | Lissamphibia |
| (sin clasif.): | Salientia |
| Orden: | Anura Fischer von Waldheim, 1813 |
| Distribución | |
 Distribución de los anuros (en negro) |
|
| Clados | |
|
Véase el texto.
|
|
Índice
Ranas y sapos
Los nombres «rana» y «sapo» se referían en un principio a los dos tipos de anuros que aparecen en la Península Ibérica: las ranas típicas (las del género Rana), y los sapos típicos (los del género Bufo); pero en la actualidad se usan para otros grupos de forma indiscriminada y arbitraria. «Rana» suele referirse a las especies más gráciles, de piel húmeda y lisa, buenas saltadoras, y de hábitos trepadores o acuáticos. «Sapo» hace referencia a las especies de piel más seca y rugosa, más robustas, marchadoras, menos ágiles y que suelen habitar en el suelo húmedo excavando galerías. Por tanto, esta distinción entre ranas y sapos no es una discriminación que tenga validez taxonómica.4Morfología

Ilustración de la estructura ósea de un anuro.
Alimentación y reproducción
Su alimentación se basa en invertebrados, tanto acuáticos como terrestres.Tienen una fecundación externa que se efectúa en el agua. El amplexus (forma de aparearse de los anuros) puede ser axilar o inguinal. Los huevos son puestos en el agua, en cordones, como hacen los sapos, o en paquetes como lo hacen las ranas y presentan dimensiones y formas diferentes según la familia o especie.
Evolución
Las primeras ranas verdaderas conocidas datan del Jurásico Inferior, Vieraella, y del Jurásico Medio, Notobatrachus. En España han aparecido especímenes de Costata del género Iberobatrachus y de Xenoanura del género Gracilibatrachus, datados en el Cretácico Inferior.9Sistemática
Las relaciones filogenéticas de Anura y las secuencias de las primeras divergencias de este clado han sido materia de una gran número de debates. La mayor parte de esta polémica se centra en la posición filogenética de los clados alguna vez asignados a Archeobatrachia (grupo parafilético compuesto por Leiopelmatidae y Ascaphidae10 ) con respecto a los clados de Neobatrachia. Este último grupo, en el cual están presentes más de 2/3 de las especies de anfibios, está formado por Heleophrynidae y un clado conformado por los grupos Hyloides y Ranoides.cladogramas están basados en Frost et al. (2006) y Heinicke et al. (2009).11 12
Familia
Se conocen las siguientes:1- Allophrynidae Savage, 1973 (2 sp.)
- Alsodidae Mivart, 1869 (30 sp.)
- Alytidae Fitzinger, 1843 (12 sp.)
- Aromobatidae Grant, Frost, Caldwell, Gagliardo, Haddad, Kok, Means, Noonan, Schargel & Wheeler, 2006 (115 sp.)
- Arthroleptidae Mivart, 1869 (144 sp.)
- Ascaphidae Fejérváry, 1923 (2 sp.)
- Batrachylidae Gallardo, 1965 (14 sp.)
- Bombinatoridae Gray, 1825 (8 sp.)
- Brachycephalidae Günther, 1858 (52 sp.)
- Brevicipitidae Bonaparte, 1850 (33 sp.)
- Bufonidae Gray, 1825 (571 sp.)
- Calyptocephalellidae Reig, 1960 (5 sp.)
- Centrolenidae Taylor, 1951 (149 sp.)
- Ceratobatrachidae Boulenger, 1884 (85 sp.)
- Ceratophryidae Tschudi, 1838 (12 sp.)
- Ceuthomantidae Heinicke, Duellman, Trueb, Means, MacCulloch & Hedges, 2009 (4 sp.)
- Conrauidae Dubois, 1992 (6 sp.)
- Craugastoridae Hedges, Duellman & Heinicke, 2008 (713 sp.)
- Cycloramphidae Bonaparte, 1850 (40 sp.)
- Dendrobatidae Cope, 1865 (177 sp.)
- Dicroglossidae Anderson, 1871 (181 sp.)
- Eleutherodactylidae Lutz, 1954 (205 sp.)
- Heleophrynidae Noble, 1931 (7 sp.)
- Hemiphractidae Peters, 1862 (100 sp.)
- Hemisotidae Cope, 1867 (9 sp.)
- Hylidae Rafinesque, 1815 (926 sp.)
- Hylodidae Günther, 1858 (42 sp.)
- Hyperoliidae Laurent, 1943 (210 sp.)
- Leiopelmatidae Mivart, 1869 (4 sp.)
- Leptodactylidae Werner, 1896 (189 sp.)
- Limnodynastidae Lynch, 1969 (43 sp.)
- Mantellidae Laurent, 1946 (204 sp.)
- Megophryidae Bonaparte, 1850 (171 sp.)
- Micrixalidae Dubois, Ohler & Biju, 2001 (11 sp.)
- Microhylidae Günther, 1858 (519 sp.)
- Myobatrachidae Schlegel, 1850 (88 sp.)
- Nasikabatrachidae Biju and Bossuyt, 2003 (1 sp.)
- Nyctibatrachidae Blommers-Schlösser, 1993 (28 sp.)
- Pelobatidae Bonaparte, 1850 (4 sp.)
- Pelodytidae Bonaparte, 1850 (3 sp.)
- Petropedetidae Noble, 1931 (12 sp.)
- Phrynobatrachidae Laurent, 1941 (85 sp.)
- Pipidae Gray, 1825 (33 sp.)
- Ptychadenidae Dubois, 1987 (53 sp.)
- Pyxicephalidae Bonaparte, 1850 (71 sp.)
- Ranidae Rafinesque, 1814 (355 sp.)
- Ranixalidae Dubois, 1987 (10 sp.)
- Rhacophoridae Hoffman, 1932 (346 sp.)
- Rhinodermatidae Bonaparte, 1850 (3 sp.)
- Rhinophrynidae Günther, 1859 (1 sp.)
- Scaphiopodidae Cope, 1865 (7 sp.)
- Sooglossidae Noble, 1931 (4 sp.)
- Telmatobiidae Fitzinger, 1843 (61 sp.)
Referencias
- ↑ Saltar a: a b Frost, Darrel R. 2013. Amphibian Species of the World: an Online Reference. Version 5.6 (9 January 2013). Electronic Database accessible at http://research.amnh.org/vz/herpetology/amphibia/?action=references&o_id=1. American Museum of Natural History, New York, USA.
- Ir a ↑ Lynch, J. D. (1976) The species groups of the South American frogs of the genus Eleutherodactylus (Leptodactylidae). Occasional Papers of the Museum of Natural History 61: 1-24.
- Ir a ↑ Sabater-Pi, J. (1985) Contribution to the biology of the Giant Frog (Conraua goliath, Boulenger). Amphibia-Reptilia, 6(2), 143-153.
- Ir a ↑ Arnold, E. N. y J. A. Burton (1978). Guía de campo de los reptiles y anfibios de España y de Europa. Barcelona: Ediciones Omega, S.A.. pp. 275. ISBN 84-282-0488-8.
- Ir a ↑ Duellman, William E.; Linda Trueb (1994) Biology of Amphibians. Johns Hopkins University Press. ISBN 978-0-8018-4780-6.
- Ir a ↑ Jr.Cleveland P Hickman, Larry S. Roberts, Allan L. Larson: Integrated Principles of Zoology, McGraw-Hill Publishing Co, 2001, ISBN 0-07-290961-7
- Ir a ↑ Storer, Tracy. General Zoology. 6th edition. MC. Graw Hill Book Company,Inc.
- Ir a ↑ Zardoya, R. & Meyer, A. (2001) On the origin of and phylogenetic relationships among living amphibians. PNAS 98:7380-7383.
- Ir a ↑ Ana María Báez. 2013. Anurans from the Early Cretaceous Lagerstätte of Las Hoyas, Spain: New evidence on the Mesozoic diversification of crown-clade Anura. Cretaceous Research, Volume 41, Pages 90–106.
- Ir a ↑ Roelants, K. & Bossuyt, F. (2005) Archaeobatrachian Paraphyly and Pangaean Diversification of Crown-Group Frogs. Systematic Biology 54(1):111-126.
- Ir a ↑ Heinicke, M. P. et al. (2009) A new frog family (Anura: Terrarana) from South America and an expanded direct-developing clade revealed by molecular phylogeny. Zootaxa 2211:1-35.
- Ir a ↑ Frost et al. (2006) The Amphibian Tree of Life. Bulletin of the American Museum of Natural History 297:1–291.
- Baez, A. M. et al. (2009) Anurans from the Lower Cretaceous Crato Formation of northeastern Brazil: Implications for the early divergence of neobatachians. Cretaceous Research 30:829-846.
- Beltz, E. (2005) Frogs: Inside their Remarkable World. Firefly Books. ISBN 1-55297-869-9.
- Cogger, H. G. et al. (2004) Encyclopedia of Reptiles & Amphibians Second Edition. Fog City Press. ISBN 1-877019-69-0.
- Estes, R. & Reig, O. A. (1973) The early fossil record of frogs: a review of the evidence. pp. 11–63 In J. L. Vial (Ed.), Evolutionary Biology of the Anurans: Contemporary Research on Major Problems. University of Missouri Press, Columbia.
- Gissi, C. et al. (2006) Mitochondrial phylogeny of Anura (Amphibia): A case study of congruent phylogenetic reconstruction using amino acid and nucleotide characters. Gene 366: 228–237.
- Sanchiz, B. (1998) Encyclopedia of Paleoherpetology Part 4. München:Pfeil.
El gato persa es una raza de gato caracterizada por tener una cara ancha y plana y un gran abundante pelaje de variados colores. Son considerados comúnmente como gatos aristocráticos (el 75% de los gatos de pedigree registrados son persas). Los primeros gatos persas fueron introducidos en Italia desde Persia (actual Irán) en la década de 1620 y a sus descendientes se les llamó de muchas maneras. La rama persa actual se desarrolló a finales de 1800 en Inglaterra y proviene del gato de Angora turco.
Índice
Historia
En general, no está claro cuando aparecieron por primera vez los gatos de pelo largo, ya que no hay gatos salvajes africanos, que se cree que son los ancestros de los gatos domésticos, con el pelo largo. La aristocracia del siglo XIX pedía gatos de pelo largo, y el gen responsable del pelo largo se introdujo a través de la hibridación con el gato de Pallas.[cita requerida] Los primeros antepasados documentados de los persas fueron importados de Jorasán, Persia, en Italia en 1620 por Pietro della Valle, y del gato de Angora (hoy Ankara), por parte de Turquía en Francia, por Nicholas Claude Fabri de Peiresc en la misma época. Los gatos de Jorasán estaban cubiertos de gris, mientras que los de angora eran blancos. De Francia pronto llegó a Gran Bretaña. También se importaron a Europa gatos de pelo largo provenientes de Afganistán, Birmania, China y Rusia. El cruce de los diferentes tipos eran comunes, especialmente entre los gatos de angora y los persas.Características
Se caracteriza por ser de un tamaño mediano a grande. Tiene la cabeza redonda, maciza y el cráneo ancho. El frente es redondeado y los pómulos son fuertes y prominentes. Tiene el hocico corto y el mentón fuerte y lleno. Los ojos son grandes, redondos, bien abiertos y separados, de un color muy intenso y brillante. Las orejas del gato persa son pequeñas y redondeadas en las puntas y cubiertas de pelo que nace de dentro hacia afuera. Así, pasan desapercibidas, confundidas con el pelo largo del lomo, patas y la cabeza.El cuerpo del gato persa es musculoso y redondeado y tiene una estructura ósea robusta. Destaca por encima de las patas que son pequeñas y gruesas.
Tiene el pelo abundante, espeso, largo y de tacto sedoso. La cola es peluda y redondeada en el extremo. Así, podemos decir que los gatos persas no destacan por ser esbeltos sino más bien macizos, redondeados y robustos.
El gato persa puede ser de colores muy variados. Hay gatos persas de un solo color igualado, intenso y sin tonos más claros, como el negro, el blanco, el azul, el chocolate, el lila, el rojo y el crema. También pueden ser de colores variados.
Los actuales gatos persas son de cuerpo compacto. Tienen un hocico respingón en una gran cabeza redonda. Su abundante y exuberante pelaje es su principal característica. Estos gatos son familiares, les encanta estar con los niños. Es un gato faldero. Su pelaje requiere un cepillado diario los baños regulares son también adecuados.
Existen también los persas himalayos, éstos difieren de los persas en el pelaje. Un gato persa himalayo tiene todas las características de un persa pero su pelaje es similar en color a los siameses. Un himalayo presenta las mismas variantes de color que los siameses, pudiendo denominarse en función del color de las partes distales (azul, chocolate rojo, lila, etc.).
Los gatos himalayos tienen los ojos azules, el punto de color o colorpoint debe estar en sus orejas, patas, lomo y cola y el resto del pelaje debe ser blanco o crema. Los puntos de color más comunes son: chocolate, lila, crema, flama, concha de tortuga carey, lince, azul.
Los gatos persas son de carácter tranquilo, se les dice tigres del sofá porque les gusta dormir y descansar. Esta raza de gatos exige mucho cuidado y dedicación por parte de los dueños.
Su crianza es difícil, el periodo de gestación es de aproximadamente 64 días y la camada es de pocas crías, por lo general dos o tres. Los gatitos suelen separarse alrededor de los tres meses de la madre.
Es presumido por naturaleza, se trata de la raza de gatos con el carácter más tranquilo, sosegado y cariñoso, de naturaleza afable, congenia tanto con los humanos como con otros animales.
Tiene un temperamento excepcionalmente apacible y doméstico que nunca ha conocido los instintos salvajes típicos de sus parientes felinos. Es tranquilo y se pasa la mayor parte del día durmiendo. Le gusta hacer ostentación de su belleza.
ORNITORRINCO
Ornithorhynchus anatinus
(Redirigido desde «Ornitorrinco»)
| Ornitorrinco | |
|---|---|
 Ornitorrinco adulto en el Acuario de Sídney. |
|
| Estado de conservación | |
 Preocupación menor (UICN)1 |
|
| Clasificación científica | |
| Reino: | Animalia |
| Filo: | Chordata |
| Subfilo: | Vertebrata |
| Clase: | Mammalia |
| Subclase: | Prototheria |
| Infraclase: | Australosphenida |
| Orden: | Monotremata |
| Suborden: | Platypoda |
| Familia: | Ornithorhynchidae |
| Género: | Ornithorhynchus |
| Especie: | O. anatinus (Shaw, 1799)2 |
| Distribución | |
![Área de distribución (en rojo: nativo, en amarillo: introducido).[1] SinonimiaPlatypus anatinus Shaw, 1799 O. novaehollandiae Lacépède, 1800 O. paradoxus Blumenbach, 1800 O. fuscus Péron, 1807 O. rufus Péron, 1807 O. crispus Macgillivray, 1827 O. laevis Macgillivray, 1827 O. brevirostris Ogilby, 1832 O. anatinus phoxinus Thomas, 1923 O. anatinus triton Thomas, 1923 Fuente: Australian Faunal Directory[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/05/Distribution_of_the_Platypus_%28Ornithorhynchus_anatinus%29.png/250px-Distribution_of_the_Platypus_%28Ornithorhynchus_anatinus%29.png) Área de distribución (en rojo: nativo, en amarillo: introducido).1 |
|
La extraña apariencia de este mamífero ponedor de huevos, venenoso, con hocico en forma de pico de pato, cola de castor y patas de nutria desconcertó a los naturalistas europeos cuando se lo encontraron por primera vez, llegando incluso a ser considerado por algunos como una elaborada falsificación.4 Es uno de los pocos mamíferos venenosos; los machos tienen un espolón en las patas posteriores que libera un veneno capaz de producir un dolor intenso a los humanos. Sus características únicas lo convierten en importante sujeto de estudio en el campo de la biología evolutiva, así como un símbolo reconocible e icónico de Australia; ha aparecido como mascota en acontecimientos nacionales y aparece al dorso de la moneda de 20 céntimos australiana. El ornitorrinco es el emblema animal del estado de Nueva Gales del Sur.5
Hasta principios del siglo XX se lo cazaba por su piel, pero actualmente está protegido en todo su ámbito de distribución. A pesar que los programas de reproducción en cautividad han tenido un éxito bastante limitado y que es una especie vulnerable a los efectos de la contaminación, no se considera que se encuentre bajo amenaza inmediata.1
Índice
Taxonomía y etimología
Cuando el ornitorrinco fue descubierto por primera vez por los europeos en 1798, el capitán John Hunter, segundo gobernador de Nueva Gales del Sur, envió un bosquejo y la piel de un ejemplar a Gran Bretaña.6 A la vista de tan extraño animal, los científicos británicos creyeron encontrarse ante una broma pesada.4 George Shaw, que en 1799 hizo la primera descripción del ornitorrinco en la revista Naturalist's Miscellany, afirmó que era imposible no haber mostrado dudas sobre su autenticidad y Robert Knox creyó que podría haber sido creado por algún taxidermista asiático.7 Se creía que alguien había cosido el pico de un pato al cuerpo de un animal parecido a un castor. Shaw incluso utilizó unas tijeras para comprobar si había suturas en la piel disecada.4Su nombre común en inglés, Platypus, es un término latinizado derivado de las palabras griegas πλατύς (platys, plano, ancho) y πους (pous, pie), «pie plano».8 Shaw se lo asignó como un nombre de género linneano cuando lo describió por primera vez (siendo el nombre de la especie Platypus anatinus), pero pronto se descubrió que ese nombre de género ya pertenecía a unos escarabajos de la madera (género Platypus).9 En 1800 fue descrito de manera independiente como Ornithorhynchus paradoxus por Johann Blumenbach, a partir de un ejemplar que le entregó Sir Joseph Banks,10 y, siguiendo las reglas de prioridad de nomenclatura, posteriormente se le reconoció oficialmente como Ornithorhynchus anatinus.9
El nombre científico se forma con Ornithorhynchus, que deriva de la palabra griega ornithorhynkhos (ορνιθόρυνχος), que significa literalmente «hocico de pájaro»; y anatinus, que en latín significa «semejante a un pato». El nombre común en español proviene también del griego ornithorhynkhos.
Morfología
Por lo general es de un color marrón intenso en la espalda y los lados de la cabeza, cuerpo y parte superior de las patas; la región ventral es de un color rubio o gris sedoso.11 El cuerpo y la ancha cola plana están cubiertos con un pelaje espeso que retiene una capa de aire aislante que mantiene al animal caliente.4 9 La cola es similar a la del castor, pero a diferencia de éste, que la emplea para propulsarse, el ornitorrinco sólo la utiliza para maniobrar en el agua; asimismo utiliza la cola como almacén de reservas de grasa, una adaptación que también presentan animales como el diablo de Tasmania (Sarcophilus harrisii).12 Tiene patas palmeadas y un gran hocico ancho y plano, cubierto de una piel suave y de aspecto similar a goma húmeda; estos rasgos son más parecidos a los encontrados en un pato que a los encontrados en cualquier mamífero conocido. La membrana que posee entre los dedos de las patas delanteras es mayor que la de las posteriores y sobrepasa el extremo de los dedos para conseguir mayor superficie de empuje, ya que es con las extremidades anteriores con las que se desplaza durante el buceo. Cuando se desplaza por tierra pliega dicha membrana hacia atrás, dejando expuestas sus fuertes uñas.9A diferencia del pico de las aves, en el que las partes superior e inferior se separan para revelar la boca, su hocico es un órgano sensorial con la boca en la parte inferior. Los orificios nasales están situados en la superficie dorsal del hocico, mientras que los ojos y las orejas se encuentran en un surco situado justo detrás del hocico; este surco se cierra cuando el animal nada.9 Tiene aproximadamente la mitad de receptores olfativos que la mayoría de los mamíferos, sin embargo cuenta con la habilidad de oler bajo el agua, adaptación valiosa durante su búsqueda subacuática de alimento. Los investigadores piensan que esta habilidad puede haberse ganado cuando el linaje de los ornitorrincos experimentó una expansión en los genes que codifican para cierto receptor de olor llamado receptor vomeronasal.13 Se ha escuchado a ornitorrincos emitir un gruñido grave cuando se los molesta, y en ejemplares en cautividad se han registrado varios tipos de vocalizaciones.4
| Peso (kg) | Longitud (cm) | |||
|---|---|---|---|---|
| Cuerpo | Cola | Hocico | ||
| Macho | 1,0 - 2,4 | 45 - 60 | 10,5 - 15,3 | 5,8 |
| Hembra | 0,7 - 1,6 | 39 - 55 | 8,3 - 12,0 | 5,2 |
Mantiene una temperatura corporal de 31-32 °C, que contrasta con los 38 °C típicos de los mamíferos placentarios.16 Las investigaciones sugieren que se trata de una adaptación gradual a condiciones ambientales duras por parte del reducido número de especies supervivientes de monotremas, y no de una característica histórica de los mismos.17 18
Las crías tienen molares tricúspides que pierden antes o justo después de dejar la madriguera donde han nacido;19 20 los adultos, en cambio, tienen en su lugar fuertes placas queratinosas.9 Su mandíbula está configurada de manera diferente a la de otros mamíferos y el músculo que la abre es diferente.9 Como en todos los mamíferos verdaderos, los pequeños huesos que conducen el sonido al oído medio están plenamente incorporados al cráneo, en lugar de estar en la mandíbula, como en los cinodontes y otros sinápsidos premamíferos. Sin embargo, la abertura externa del oído todavía permanece en la base de la mandíbula.9 El ornitorrinco tiene siete vértebras cervicales, el número habitual en los mamíferos, sin embargo cuenta con huesos adicionales en la cintura escapular, incluida una interclavícula, que no se encuentra en otros mamíferos, y muestra algunos rasgos reptilianos en su esqueleto.9 También tiene un andar semejante a los reptiles, con las patas situadas en los lados del cuerpo, no debajo,9 y, para evitar posibles daños en la gran membrana interdigital de sus patas delanteras, se desplaza apoyándose sobre los nudillos.21
Veneno
El veneno parece tener una función diferente a la del producido por especies no mamíferas; sus efectos no suelen ser letales, pero son lo bastante potentes como para debilitar seriamente a la víctima. Puesto que sólo los machos producen veneno y la producción aumenta durante la época de apareamiento, se teoriza que es utilizado como arma ofensiva para hacer valer su dominio durante este período.22
Electrolocalización
Los monotremas son los únicos mamíferos de los que se sabe que tienen un sentido de electrorrecepción; localizan sus presas, en parte, mediante la detección de campos eléctricos generados por las contracciones musculares de éstas. La electrorrecepción del ornitorrinco es la más sensible de todos los monotremas.25 26Puede determinar la dirección de una fuente eléctrica, posiblemente comparando diferencias en la intensidad de la señal a lo largo de la capa de electrorreceptores. Esto explicaría el movimiento característico de la cabeza del animal de un lado a otro cuando sale a cazar. La convergencia cortical de los estímulos electrosensoriales y táctiles sugieren la existencia de un mecanismo para determinar la distancia de las presas que, cuando se mueven, emiten tanto señales eléctricas como pulsos de presión mecánicos, lo que también permitiría calcular la distancia a partir de la diferencia en el tiempo de llegada de las dos señales.25
El ornitorrinco no busca alimento mediante la vista o el olfato,29 cierra sus ojos, oídos y nariz cuando se zambulle,30 y excava con el hocico en el fondo de riachuelos. Los electrorreceptores de su hocico detectan los pequeños movimientos de sus presas al distinguir los objetos animados de los inanimados en esta situación en que los mecanorreceptores están constantemente estimulados.25 Las presas generarían minúsculas corrientes eléctricas con sus contracciones musculares que podrían ser detectados por sus sensibles electrorreceptores. Se ha demostrado experimentalmente que el ornitorrinco reacciona ante un «camarón» artificial si se hace pasar una corriente eléctrica débil a través de él.31
Ecología y comportamiento
Es un animal semiacuático y vive en pequeños riachuelos y ríos en un área biogeográfica que cuenta con una amplia variedad de hábitats y climas, que va desde las frías zonas montañosas de Tasmania y los Alpes Australianos hasta las selvas tropicales de las costas de Queensland.11 No se tiene conocimiento de su distribución en el interior australiano; se extinguió en Australia Meridional, salvo una población introducida en la isla Canguro entre 1929 y 1946 que todavía mantiene poblaciones activas,32 33 y ya no habita en gran parte de la cuenca Murray-Darling, posiblemente debido al declive de la calidad del agua provocado por la tala de árboles y la irrigación a gran escala.34 A lo largo de los sistemas fluviales costeros, su distribución es impredecible; parece estar ausente de algunos ríos relativamente sanos, pero continúa viviendo en otros que están bastante degradados (como el curso bajo del río Maribyrnong).35
Vídeo mostrando su comportamiento en el Acuario de Sídney. En cautiverio algunos ejemplares han sobrevivido hasta los diecisiete años de edad.
El ornitorrinco es un nadador excelente y pasa gran parte del tiempo en el agua buscando alimento. Cuando nada, puede distinguirse de otros mamíferos australianos por la ausencia de orejas visibles.41 Una de sus características, única entre los mamíferos, es que nada impulsándose en el agua batiendo alternativamente las patas delanteras; aunque sus cuatro patas están palmeadas, las posteriores, que pliega contra el cuerpo, no contribuyen al impulso sino que sirven para la dirección, en combinación con la cola.42 Es una especie homeoterma que mantiene su temperatura corporal en torno a 32 °C (inferior a la de la mayoría de mamíferos) incluso cuando busca alimento durante horas en aguas por debajo de los 5 °C.9
Normalmente sus inmersiones duran unos 30 segundos; pueden durar más pero pocas superan su límite aeróbico estimado de 40 segundos. Para recuperarse de sus inmersiones pasa entre 10 y 20 segundos en la superficie del agua.43 44 El ornitorrinco es carnívoro; se alimenta de anélidos, larvas de insectos, camarones de agua dulce y cangrejos de río que extrae del fondo fluvial escarbando con el hocico o que caza mientras nada. Utiliza unos sacos maxilares para almacenar su alimento junto con piedras de pequeño tamaño que le ayudan a triturarlo. Una vez que los sacos están llenos, o cuando captura una presa de mayor tamaño, asciende a la superficie para ingerir las capturas.41 Necesita comer aproximadamente un 20% de su peso cada día. Esto implica que tiene que pasar una media de 12 horas al día buscando alimento.43 Cuando no se encuentra dentro del agua, se retira a una pequeña y recta madriguera de reposo, de corte transversal oval, situada casi siempre en la orilla un poco por encima del nivel del agua, y a menudo escondida bajo una maraña protectora de raíces.41
Reproducción
Cuando los europeos descubrieron al ornitorrinco, los científicos estaban divididos sobre la cuestión de si la hembra ponía huevos. Este hecho no fue confirmado hasta 1884, cuando W. H. Caldwell fue enviado a Australia, donde, después de una intensa investigación ayudado por un equipo de 150 aborígenes, consiguió encontrar algunos huevos.9 22 Consciente del elevado precio de enviar un telegrama al Reino Unido basado en el coste por palabra, Caldwell envió un célebre y lacónico mensaje a Londres: «Monotremes oviparous, ovum meroblastic» (Monotremas ovíparos, huevo meroblástico).45 Es decir, los monotremas ponen huevos, y los huevos se asemejan a los de los reptiles en el hecho que sólo una parte del huevo se divide durante el desarrollo.La especie sólo tiene un período de apareamiento; después de un complicado cortejo que termina con la pareja nadando unida describiendo círculos lentamente, mientras el macho sujeta con el pico la cola de la hembra,46 la copulación se produce entre junio y octubre, con una cierta variación local a lo largo de su área de distribución.36 La observación histórica, los estudios basados en el marcaje y la recaptura, e investigaciones preliminares de genética de poblaciones indican la posibilidad de que haya miembros permanentes y temporales en las poblaciones, y sugieren un sistema de apareamiento poligínico.47 Se cree que las hembras se vuelven sexualmente activas durante su segundo año de vida, y se ha confirmado que animales de más de nueve años de edad todavía se aparean.47
Fuera de la temporada de apareamiento, el ornitorrinco vive en una sencilla madriguera de tierra, con la entrada unos 30 cm por encima del nivel del agua. Después del acoplamiento, la hembra construye una madriguera más profunda y elaborada de hasta 20 metros de longitud, y la tapona a intervalos, quizás como protección contra la subida del nivel del agua o contra predadores, o como método de regulación de la humedad y la temperatura.48 El macho no desarrolla ningún papel en la cría de la descendencia, y se retira a su madriguera. La hembra recubre y acolcha la tierra de la madriguera con hojas muertas y húmedas y llena el nido al final del túnel con hojas muertas y cañas para realizar la cama, donde incubará sus huevos. Arrastra este material al nido enroscándolo con su cola.4
Las hembras tienen un par de ovarios, pero sólo el izquierdo es funcional.38 Ponen entre uno y tres (generalmente dos) huevos pequeños y coriáceos (parecidos a los de los reptiles), que miden unos 11 mm de diámetro y son un poco más redondeados que los de las aves.49 Los huevos se desarrollan en el útero durante unos 28 días, con sólo unos 10 días de incubación externa (a diferencia de los huevos de gallina, que pasan un día en el tracto y tres semanas en el exterior).38 Tras la puesta de estos huevos pegajosos y de cáscara fina, la hembra se acurruca a su alrededor sosteniéndolos contra su vientre con la cola.36 El período de incubación se divide en tres partes. En la primera el embrión carece de órganos funcionales y se mantiene gracias al saco de vitelo. El vitelo es absorbido por la cría en desarrollo.50 Durante la segunda se desarrollan los dedos, y en la última aparece el «diente de huevo».38 51
Los recién nacidos son vulnerables, ciegos y sin pelo, y son alimentados con la leche de la madre. Aunque posee glándulas mamarias, carece de pezones; la leche se libera a través de los poros de la piel. La hembra tiene unos surcos en el abdomen que forman balsas de leche que permiten a las crías lamerla.4 36 Tras la eclosión, las crías son amamantadas durante tres o cuatro meses. Durante la incubación y el período de lactancia la madre inicialmente sólo deja la madriguera por períodos cortos de tiempo para buscar alimento. Cuando lo hace, crea una serie de delgados tapones de tierra a lo largo de la madriguera, posiblemente para proteger a las crías de los predadores; cuando empuja estos tapones durante el regreso, le absorben el agua del pelaje, lo que permite que la madriguera permanezca seca.52 Transcurridas unas cinco semanas, la madre empieza a pasar más tiempo separada de las crías y, cuando tienen unos cuatro meses, abandonan la madriguera.36 Los ornitorrincos nacen con dientes, pero se les caen a una edad muy temprana, dejando unas placas córneas con las que muelen la comida.53
Evolución
El fósil más antiguo descubierto de ornitorrinco moderno data de hace unos 100 000 años, durante el período Pleistoceno. Los monotremas extintos (Teinolophos y Steropodon) estaban estrechamente relacionados con el ornitorrinco moderno.55 Un Steropodon fosilizado fue descubierto en Nueva Gales del Sur, consistente en un maxilar inferior opalizado con tres dientes molares (mientras que el ornitorrinco adulto moderno carece de dientes). Inicialmente se creyó que los molares eran tribosfénicos, cosa que habría apoyado una variación de la teoría de Gregory, pero investigaciones posteriores sugirieron que, a pesar de tener tres cúspides, evolucionaron en un proceso separado.19 Se cree que el fósil tiene unos 110 millones de años de antigüedad, lo que significa que este animal parecido al ornitorrinco vivía en el período Cretácico, lo que lo convierte en el fósil de mamífero más antiguo descubierto en Australia. Monotrematum sudamericanum, otro pariente extinto del ornitorrinco fue descubierto en Argentina, lo que indica que los monotremas estaban presentes en el supercontinente de Gondwana cuando los continentes de Sudamérica y Australia estaban unidos vía la Antártida.19 58
Debido a la divergencia temprana de los mamíferos terios y el reducido número de especies vivientes de monotremas, el ornitorrinco es un importante y frecuente sujeto de estudio en el campo de la biología evolutiva. En 2004 investigadores de la Universidad Nacional de Australia descubrieron que tiene diez cromosomas sexuales, en contraste con los dos (XY) de la mayoría de los mamíferos (por ejemplo, un macho siempre será XYXYXYXYXY).59 A pesar de que se les da la designación XY de los mamíferos, los cromosomas sexuales del ornitorrinco son más similares a los cromosomas sexuales ZZ/ZW de las aves. Su genoma también tiene genes tanto reptilianos como mamiferoides asociados con la fertilización de los huevos.60 Dado que carece del gen SRY que determina el sexo en los mamíferos, todavía no se conoce el proceso de determinación del sexo del ornitorrinco.61 62 El 8 de mayo del 2008 se publicó una versión preliminar de su secuencia genómica en la revista Nature, que mostraba elementos tanto de reptiles como de mamíferos, así como dos genes que anteriormente sólo se habían descubierto en aves, anfibios y peces. El estudio encontró que más del 80% de sus genes son comunes a los mamíferos de los que se han secuenciado los genes, y que el genoma del ornitorrinco, como el animal en sí, es una amalgama de ancestros reptilianos y características derivadas de los mamíferos.60
Estado de conservación
Excepto por su desaparición del estado de Australia Meridional, el ornitorrinco ocupa la misma distribución general que antes de la colonización europea de Australia. Sin embargo se han documentado cambios locales y la fragmentación de su distribución debido a la modificación de su hábitat por parte de los humanos. Por otro lado, su abundancia actual e histórica no es muy conocida y probablemente ha sufrido un declive de sus poblaciones, a pesar de que todavía se lo considera común en la mayor parte de su distribución actual.39 La especie fue intensamente cazada por su piel hasta los primeros años del siglo XX y, a pesar de estar protegida en toda Australia a partir de 1905,52 hasta 1950 todavía corría el peligro de ahogarse en las redes de los pesqueros de interior.34 El ornitorrinco no parece correr un peligro inmediato de extinción gracias a las medidas de conservación adoptadas, pero podría verse afectado por la destrucción de su hábitat provocada por los embalses, la irrigación y la contaminación y por las muertes por ahogamiento al quedar atrapados en las redes y las trampas colocadas para la captura de peces y crustáceos.1 Existen estrictas normas que impiden su exportación, por lo que solamente se le puede encontrar, tanto en libertad como en cautividad, en territorio australiano.63 La Unión Internacional para la Conservación de la Naturaleza lo lista como especie bajo preocupación menor en su Lista Roja,1 aunque algunos investigadores consideran que debería ser clasificada como «potencialmente vulnerable» debido a su dependencia de ambientes acuáticos amenazados por las sequías, el cambio climático y la degradación a causa de las actividades humanas.64Los ornitorrincos sufren generalmente pocas enfermedades en estado salvaje; sin embargo en Tasmania existe una gran preocupación sobre el potencial impacto de una enfermedad causada por el hongo Mucor amphibiorum. La enfermedad (denominada «mucormicosis») sólo afecta a los ornitorrincos de Tasmania, y no ha sido observada en el resto del continente australiano. Los animales afectados pueden desarrollar desagradables lesiones cutáneas o úlceras en varias partes del cuerpo, como la espalda, la cola y las patas. La mucormicosis puede matarlos; la muerte viene provocada por infecciones secundarias y porque queda afectada la capacidad del animal para mantener su temperatura corporal y su eficiencia a la hora de buscar alimento. La Sección de Conservación de la Biodiversidad del Departamento de Industrias Primarias y Agua está colaborando con varios departamentos gubernamentales e investigadores de dos universidades australianas para determinar el impacto de la enfermedad sobre los ornitorrincos de Tasmania, así como el mecanismo de transmisión y la difusión de la enfermedad.65
La mayor parte del mundo conoció al ornitorrinco en 1939 cuando la National Geographic Magazine publicó un artículo sobre este sorprendente animal y los esfuerzos llevados a cabo para su estudio y cría en cautividad. Se trataba de una tarea difícil, y desde entonces sólo se ha conseguido criar con éxito unos pocos ejemplares. La figura más destacada de estos esfuerzos fue David Fleay, que puso en marcha un «ornitorrincuario» simulando un riachuelo dentro de un tanque en el Healesville Sanctuary en Victoria, donde consiguió el primer nacimiento con éxito de un ornitorrinco en cautividad en 1943. En 1972 encontró una cría muerta de unos cincuenta días de edad, que presumiblemente había nacido en cautividad, en su parque faunístico de Burleigh Heads en la Costa de Oro de Queensland.66 Healesville volvió a tener éxito en 1998 y de nuevo en 1999 con un tanque con un riachuelo similar al montado en los años 1940. El Zoo de Taronga de Sídney consiguió el nacimiento de gemelos en 2003,67 y hubo un nuevo nacimiento con éxito en 2006.68
Referencias culturales
Dadas las singulares características del ornitorrinco, a veces se ha dicho, a modo de broma, que es una prueba de que Dios tiene sentido del humor (por ejemplo, al inicio de la película Dogma). Como símbolo de lo extraño se ha utilizado para algunas reflexiones filosóficas, como por ejemplo las de Umberto Eco en su obra Kant y el ornitorrinco (1997) o las de Thomas Cathcart en Platón y un ornitorrinco entran en un bar... La filosofía explicada con humor (2008).Aparece a menudo como personaje de programas infantiles de televisión, como el popular «Perry el Ornitorrinco» en el programa Phineas y Ferb de Disney Channel, o «la familia Ornitorrinco» de Mister Rogers' Neighborhood, y es protagonista de poemas infantiles de autores como el australiano Banjo Paterson o de la española Gloria Fuertes.69 70 También ha aparecido en algunos temas musicales, como Platypus (I Hate You) de Green Day o Platypus de Mr. Bungle.
Su peculiar apariencia ha hecho que aparezca en muchos medios, especialmente en su Australia natal. Se ha usado en varias ocasiones como mascota: «Syd» el ornitorrinco fue una de las tres mascotas elegidas para los Juegos Olímpicos de Sídney 2000, junto con un equidna y una cucaburra,71 «Expo Oz» lo fue en la Exposición Mundial de 1988 celebrada en Brisbane,72 y el ornitorrinco «Hexley» es la mascota del sistema operativo Darwin, de Apple, uno de los principales componentes en los que se basan Mac OS X e iPhone OS.73
Desde la introducción del sistema decimal en las monedas de Australia en 1966, la imagen decorada en relieve de un ornitorrinco figura en el reverso de la moneda de 20 céntimos. El ornitorrinco es el emblema animal del estado de Nueva Gales del Sur.5








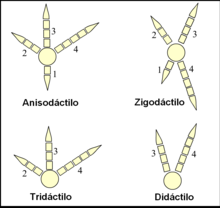
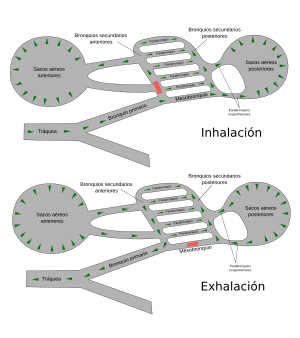















No hay comentarios:
Publicar un comentario